Introduzione
La cheratopatia neurotrofica (neurotrophic keratopathy-NK) è una patologia degenerativa della cornea caratterizzata dalla compromissione parziale o totale dell'innervazione trigeminale corneale (1,2).
Il danno all’innervazione corneale determina sia la riduzione della sensibilità corneale, sia la mancanza del supporto trofico fisiologicamente fornito ai tessuti corneali da parte delle terminazioni nervose (3).
La riduzione del supporto trofico determina l’insorgenza di alterazioni morfologiche, metaboliche e funzionali delle cellule corneali con conseguente sviluppo di lesioni epiteliali e ulcere corneali che hanno scarsa o assente tendenza ala guarigione spontanea (4).
Infatti, i nervi corneali, attraverso la produzione di neuromediatori e fattori di crescita, svolgono un ruolo fondamentale nel mantenimento del trofismo corneale, del rinnovo dell'epitelio e della capacità di riparazione delle lesioni (1,3,4).
Di conseguenza, tutte le patologie locali e sistemiche che causano alterazioni dell'innervazione della cornea possono indurre lo sviluppo di cheratopatia neurotrofica (2).
La causa più frequente di NK è la cheratite erpetica da herpes simplex o herpes zoster, altre cause comuni di NK sono lesioni dell’innervazione a seguito di interventi neurochirurgici o di chirurgia oculare, il diabete, l’uso cronico di lenti a contatto, le terapie topiche croniche, l’abuso di anestetici topici (1).
Il quadro clinico della cheratopatia neurotroficaè caratterizzato dalla riduzione parziale o totale della sensibilità corneale che si associa allo sviluppo di alterazioni degenerative corneali, rotture spontanee dell’epitelio corneale, presenza di difetti epiteliali ricorrenti o persistenti, ulcere corneali, necrosi asettica e può portare alla perforazione corneale (1).
La compromissione dell’innervazione corneale causa anche alterazione del riflesso lacrimale con riduzione della produzione lacrimale e, nelle forme bilaterali riduzione della frequenza dell’ammiccamento (2).
La diagnosi di NK si basa sulla presenza di difetti epiteliali o ulcera corneale non infettivi, associati a diminuzione o assenza di sensibilità corneale, che può essere valutata toccando la cornea con la punta di un filo di cotone o misurata attraverso l’uso di estesiometri corneali (3-5).
La stadiazione della NK si basa sulla severità clinica.
Lo stadio 1 della NK è caratterizzato dalla presenza di epitelio distrofico, grigiastro e/o di cheratite puntata superficiale, lo stadio 2 è caratterizzato dalla presenza di difetti epiteliali ricorrenti e/o persistenti e lo stadio 3 dalla presenza di un'ulcera corneale che può progredire verso la necrosi asettica e la perforazione (2).
Il trattamento della NK è finalizzato al ripristino dell’integrità corneale e alla stimolazione della rigenerazione nervosa ed epiteliale (2,3).
La terapia medica prevede l’utilizzo di lubrificanti oculari senza conservanti associati ad un antibiotico di copertura in presenza di un difetto epiteliale.
Nel caso in cui questi non siano efficaci, l’uso di Cenegermin in collirio è stato recentemente approvato in Italia per il trattamento della NK allo stadio 2 e 3. Il Cenegermin è un Nerve Growth Factor ricombinante umano (rhNGF) recentemente sviluppato e prodotto da Dompé Farmaceutici SPA (Milano, Italia).
Cenegermin ha ottenuto la designazione di farmaco orfano dall'European Medicine Agency (EMA) a dicembre 2015 e l'autorizzazione all'immissione in commercio dalla Commissione europea per il trattamento della cheratopatia neurotrofica da moderata a grave a luglio 2017 (6).
In Italia è disponibile per i pazienti e viene dispensato come farmaco ospedaliero dal Gennaio 2018.
Il trattamento con Cenegermin in collirio ha dimostrato di essere sicuro e ben tollerato e di indurre la guarigione corneale e migliorare la funzione visiva in due studi clinici di fase II in pazienti con NK allo stadio 2 e 3 (6-8).
In alternativa, la terapia della NK prevede l’uso di lenti a contatto terapeutiche o la terapia chirurgica, che è riservata ai casi refrattari alla terapia medica o in presenza di complicanze come la perforazione corneale, ed è finalizzata a ripristinare l’integrità del bulbo oculare e fermare la progressione della malattia (1).
Tra le opzioni chirurgiche le più comuni sono la tarsorrafia, il trapianto di membrana amniotica o il ricoprimento congiuntivale. Tuttavia, queste opzioni spesso non sono ben accettate dai pazienti a causa dello scarso impatto estetico e della ridotta funzione visiva (1).

Cheratite neurotrofica: il caso clinico
Il caso in questione riguarda (cheratite neurotrofica) una paziente donna di 64 anni che si presenta alla nostra osservazione con una ulcera corneale in occhio destro da circa un mese per cui era stata applicata una lente a contatto terapeutica, associata a lubrificanti oculari e una terapia antibiotica di profilassi con antibiotico in collirio senza conservanti 2 volte al giorno.
Tale trattamento non aveva avuto efficacia e l’ulcera non mostrava segni di riparazione corneale.
La paziente in anamnesi riferiva diagnosi, 11 anni prima, di sindrome di Miller Fisher, una rara neuropatia infiammatoria-demielinizzante acuta, caratterizzata da triade atassia, oftalmoplegia e areflessia, ritenuta una variante rara della sindrome di Guillain-Barrè.
Tale patologia era stata trattata con immunoglobuline endovena e si era risolta con completo recupero in 12 mesi.
La paziente riferiva inoltre ipertensione arteriosa sistemica in trattamento con farmaci ipotensivi e ipotiroidismo in terapia sostitutiva.
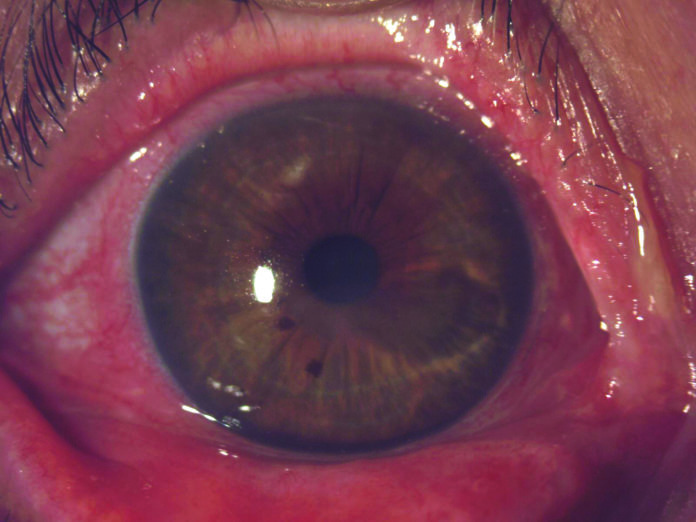
All’esame obiettivo in occhio destro presentava lieve iperemia congiuntivale, presenza di ulcera corneale centrale, positiva alla colorazione con fluoresceina (Figura 1 A, B). In occhio sinistro il segmento anteriore risultava nella norma.
Acuità visiva in OD=3/10; OS=10/10
La paziente presentava ipoestesia corneale in occhio destro, misurata con estesiometro di Cochet-Bonnet= 3 cm. In occhio sinistro l’estesiometria era normale (6 cm all’estesiometria di Cochet Bonnet). Inoltre presentava un quadro di moderata secchezza oculare con Schirmer test senza anestesia in occhio destro di 5 mm/5 minuti e in occhio sinistro di 8 mm/5 minuti.
Sono stati eseguiti esami microbiologici che hanno escluso la presenza di infezioni corneali.
La paziente è stata trattata con Cenegermin alla concentrazione di 20µg/ml 6 volte al giorno in occhio destro. Dopo 14 giorni di trattamento l’ulcera era in via di guarigione e dopo 4 settimane la cornea presentava epitelio integro, negativo alla colorazione con fluoresceina (Figura 1 C, D).
L’estesiometria corneale centrale era di 4 cm e l’acuità visiva OD=5/10. La paziente al termine del ciclo di trattamento di 8 settimane presentava un quadro clinico stabile con epitelio integro, estesiometria corneale centrale OD= 5 cm, Schirmer test senza anestesia in OD= 5 mm/5minuti e acuità visiva OD= 6/10. (Figura 1 E, F)
Attualmente, la paziente è in trattamento con lubrificanti oculari senza conservanti ed il quadro clinico è stabile e non ha avuto recidive delle lesioni corneali.
Conclusioni
Nel caso clinico descritto la paziente presentava un’ulcera corneale neurotrofica (stadio 3) che era stata trattata con lubrificanti oculari e lente a contatto terapeutica senza miglioramento clinico.
In questa paziente, il trattamento con Cenegermin in collirio ha consentito di ottenere una rapida guarigione dell’ulcera corneale associata ad un aumento della sensibilità corneale, senza recidive dopo la sospensione del farmaco.
Questo caso clinico evidenza l’importanza di una corretta diagnosi al fine di riconoscere la cheratite neurotrofica e impostare rapidamente il trattamento più adeguato evitando l’insorgenza di complicanze quali la necrosi asettica e la perforazione corneale.
E’ importate considerare che in presenza di difetti epiteliali o ulcere corneali ricorrenti e/o persistenti, asettici e con scarsa o assente tendenza alla guarigione spontanea, è oggi fondamentale valutare la sensibilità corneale al fine di fare diagnosi di ulcera corneale neurotrofica ed effettuare una trattamento adeguato alla patologia.
Inoltre, da pochi mesi in Italia è disponibile il farmaco Cenegermin in collirio, approvato specificatamente per il trattamento della NK allo stadio 2 (difetto epiteliale) e 3 (ulcera corneale) (6).
Studi sperimentali hanno dimostrato che Cenegermin esercita un'attività biologica in vitro e ha un profilo farmacologico sicuro in vivo (6).
I trials clinici hanno confermato la sicurezza del trattamento topico Cenegermin in soggetti sani e in pazienti con NK, in cui ha dimostrato efficacia nel ripristinare l’integrità corneale inducendo la completa riparazione della cornea in oltre il 70% dei pazienti trattati e di mantenere il risultato a distanza di 1 anno in oltre il 90% dei casi (7,8).
- Sacchetti M, Lambiase A. Diagnosis and management of neurotrophic keratitis. Clinical ophthalmology. 2014;8:571-579.
- Bonini S, Rama P, Olzi D, Lambiase A. Neurotrophic keratitis. Eye. 2003;17(8):989-995.
- Mastropasqua L, Massaro-Giordano G, Nubile M, Sacchetti M. Understanding the Pathogenesis of Neurotrophic Keratitis: The Role of Corneal Nerves. Journal of cellular physiology. 2017;232(4):717-724.
- Sacchetti M, Lambiase A. Neurotrophic factors and corneal nerve regeneration. Neural regeneration research. 2017;12(8):1220-1224.
- Golebiowski B, Papas E, Stapleton F. Assessing the sensory function of the ocular surface: implications of use of a non-contact air jet aesthesiometer versus the Cochet-Bonnet aesthesiometer. Experimental eye research. 2011;92(5):408-413.
- Sacchetti M, Bruscolini A, Lambiase A. Cenegermin for the treatment of neurotrophic keratitis. Drugs of today. 2017;53(11):585-595.
- Bonini S, Lambiase A, Rama P, et al. Phase I Trial of Recombinant Human Nerve Growth Factor for Neurotrophic Keratitis. Ophthalmology.2018.
- Bonini S, Lambiase A, Rama P, et al. Phase 2 Randomized, Double-Masked, Vehicle-Controlled Trial of Recombinant Human Nerve Growth Factor for Neurotrophic Keratitis. Ophthalmology. 2018.