(Sindromi masquerades) Autore: Chiara Giuffrè
Medico specializzando in oftalmologia, dipartimento di oftalmologia, IRCCS ospedale San Raffaele, Milano
Era il 1967 quando Theodore per primo utilizzò il termine “masquerade syndrome” (sindromi masquerades) per riferirsi ad un carcinoma congiuntivale che si presentava nella forma di una congiuntivite cronica. [1]
Oggi per “sindrome masquerade” si intende una patologia, di solito – ma non sempre - neoplastica, che mima un processo infiammatorio oculare.
La diagnosi precoce di tale sindrome è essenziale poiché una terapia instaurata prontamente può migliorare non solo la prognosi visiva del paziente ma anche la sua prognosi quoad vitam.
Tra le sindromi masquerades la più comune è senza dubbio il linfoma vitreoretinico primario (PVRL) a cellule B, che costituisce un subset del linfoma primario del sistema nervoso centrale (PCNSL): si stima che il 25% dei pazienti con PCNSL ha anche PVRL, e la metà dei pazienti con PVRL svilupperanno malattia estesa al sistema nervoso centrale (SNC).[2]
Nell’80-90% dei casi inoltre il PVRL è bilaterale. [3]
Le manifestazioni del PVRL sono subdole dal momento che il paziente si presenta quasi sempre solo con un calo della vista e con miodesopsie causati dall’imponente vitreite, spesso unico segno visibile del progresso neoplastico in atto.
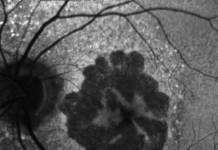
La vitreite e - se presenti - le lesioni infiltrative bianco-giallastre al fondo fanno scambiare la patologia per un uveite intermedia o posteriore che viene trattata con anti-infiammatori steroidei.
Questi ultimi, però, non solo non risolvono il quadro, ma pongono anche importanti problematiche per la diagnosi di certezza istologica che spesso risulta falsamente negativa per l’azione anti-infiammatoria.
Altri segni oculari di malattia sono l’angite “frosted branch”, l’ostruzione arteriolare, la vasculite retinica e le cicatrici corioretiniche. [4]
Oltre a guardare l’occhio è opportuno fare attenzione a segni neurologici come cambi comportamentali del paziente, emiparesi, epilessia o paralisi dei nervi cranici, segni inconfutabili di malattia estesa al sistema nervoso centrale. [5]
Sindromi masquerades, la sfida
Come già inteso, la diagnosi del PVRL è una vera e propria sfida per l’oculista: da un lato lesioni al fondo che mimano altri processi infiammatori, dall’altro la difficoltà di avere una diagnosi bioptica di certezza.
A proposito del primo punto le tecniche di imaging moderne possono essere di supporto evidenziando dei quadri tipici.
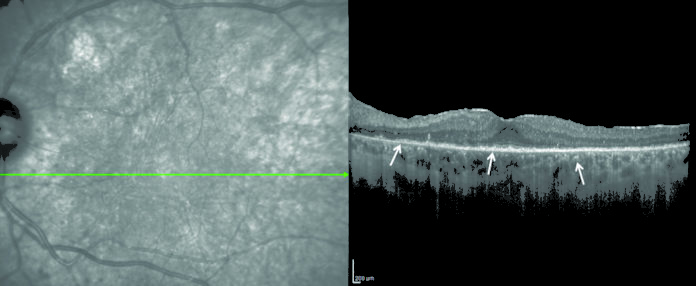
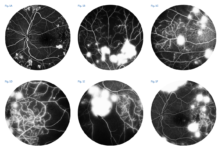
Nella fattispecie, alla fluorangiografia retinica gli infiltrati sotto l’epitelio pigmentato retinico (EPR) appariranno più ipofluorescenti per effetto maschera, mentre le zone di atrofia dell’EPR, dopo riassorbimento dell’infiltrato si evidenzieranno come iperfluorescenti per effetto finestra.
Questo quadro di iperfluorescenze e di ipofluorescenze alternate prende il nome di “leopard spot”, assomigliando al manto maculato del leopardo.
Lo stesso quadro di alternanza di spot ipo e spot iper si può osservare all’autofluorescenza come aree iperautofluorescenti (gli infiltrati) e aree ipoautofluorescenti (l’atrofia). [6]
All’optical coherence tomography (OCT) il segno più tipico è l’accumulo di materiale iperriflettente sottoretinico o sotto l’EPR. [7]
Il secondo punto che rende difficile la diagnosi di certezza riguarda la biopsia vitreale (la biopsia corioretinica e l’aspirazione del materiale sottoretinico, per i rischi di esecuzione sono relegate a casi limite di dubbio diagnostico).
La biopsia vitreale va eseguita sull’occhio con più vitreite, e serve per l’esame citologico ovvero l’analisi delle cellule B monoclonali (sono cellule fragili e i falsi negativi sono frequenti!) e per l’immunocitochimica o la citometria a flusso che consiste nell’evidenziazione dei marker sulla membrana dei linfociti (e.g. CD 19, CD20, CD21).
Si può anche effettuare la ricerca della citochina principalmente prodotta dai linfociti B (IL10) e confrontare la sua quantità con l’IL6, tipica dei processi infiammatori che invece sarà poco rappresentata (un rapporto IL10/IL6 alto è a favore del linfoma). [8]
Recentemente è stata inoltre proposta la ricerca nel vitreo della mutazione MYD88 L265P che codifica per una proteina mutata presente nei linfomi dei siti immunologicamente privilegiati come occhio, SNC e testicoli, e trovata con un’alta prevalenza nel PVRL. [9]
Per escludere il coinvolgimento del SNC è opportuno prescrivere una risonanza magnetica con contrasto ed eventualmente un esame del liquido cefalorachidiano per la ricerca delle cellule B monoclonali. La biopsia cerebrale può essere necessaria in casi selezionati.
Una volta stabilita la diagnosi, il trattamento varia in base al coinvolgimento solamente degli occhi o anche del SNC.
In generale non esistono delle linee guida univoche. Se solo l’occhio è coinvolto senza interessamento del SNC, è stata proposta l’iniezione intravitreale di sostanze immunosoppressive come il Metotrexate o biologiche come il Rituximab (anti-CD20) o la radioterapia oculare.
Se invece già è evidente il coinvolgimento del SNC la chemioterapia sistemica associata più o meno alla radioterapia cerebrale o il trapianto autologo di cellule staminali sono delle valide opzioni terapeutiche. [10]
La prognosi del PVRL è strettamente legata al coinvolgimento del SNC. Se infatti quest’ultimo è coinvolto, la prognosi è infausta con una sopravvivenza generale del 32% a 4 anni. [11]
Per concludere è importante che l’oculista riconosca prontamente il PVRL per le ripercussioni che questo può avere sulla salute e sulla vita del paziente, e per riferire il paziente ai colleghi della oncoematologia per una valutazione sistemica precoce.
Alcuni studi evidenziano che un trattamento preventivo sistemico nei casi senza lesioni cerebrali, per quanto non inibisca lo sviluppo del PCNSL, almeno ritarda la sua comparsa.[12]
Allo stato attuale non ci sono degli studi univoci, ma intanto un’attenta anamnesi per escludere altre cause infiammatorie, un buon esame obiettivo coadiuvato dall’imaging, e soprattutto una diagnosi cito-immunologica/genetica con gli strumenti di cui oggi disponiamo può essere cruciale per la sopravvivenza del paziente affetto dal PVRL.
Bibliografia
- Theodore FH. Conjunctival carcinoma masquerading as chronic conjunctivitis. Eye Ear Nose Throat Mo. 1967;46:1419-20.
- Grimm SA, Pulido JS, Jahnke K et al. Primary intraocular lymphoma: an International Primary Central Nervous System Collaborative Group Report. Ann Oncol. 2007;18:1851-55.
- Coupland SE, Heimann H, Bechrakis NE. Primary intraocular lymphoma: a review of the clinical, histopathologicak and molecular biological features. Graefes Arch Clin Exp Ophthalmol. 2004;242:901-13.
- Chan CC, Gonzales JA. Primary Intraocular Lymphoma. World Scientific Publishing Co. Pte. Ltd. Hackensack, NJ. 2007.
- Bataille B, Delwail V, Menet E at al. Primary intracerebral malignant lymphoma: report of 248 cases. J Neurosurg. 2000;92:261.
- Casady M, Faia L, Nazemzadeh M, et al. Fundus autofluorescence patterns in primary intraocular lymphoma. Retina. 2014;34:366-72.
- Liu TY, Ibrahim M, Bittencourt M et al. Retinal optical coherence tomography manifestation of intraocular lymphoma. J Ophthalmic Inflamm Infect. 2012;2:215-18.
- Sen HN, Badaghi B, Hoang PL et al. Primary intraocular lymphoma: diagnosis and differential diagnosis. Ocul Immunol Inflamm. 2009;17:133-141.
- Raja H, Salomão D, Viswanatha D et al. Prevalence of MYD88 L265P mutation in histologically proven, diffuse large B-cell vitreoretinal lymphoma. Retina. 2016;36:624-28
- Kasenda B, Schorb E, Fritsch K et al. Prognosis after high-dose chemotherapy followed by autologous stem-cell transplantation as first-line treatment in primary CNS lymphoma:a long term follow-up study. Ann Oncol. 2012;23:2670-75.
- Riemens A, Bromberg J, Touitou V at al. Treatment strategies in primary vitreoretinal lymphoma: a 17-center European collaborative study. Jama Ophthalmol. 2015;133:191-97.
- Noriyasu H, Kei N, Norimitsu S et al. Association between ocular findings and preventive therapy with onset of central nervous system involvement in patients with primary vitreoretinal lymphoma. Graefes Arch Clin Exp Ophthalmol. 2014;252:687-93.
Figura 1: Ultra-wide field multimodal imaging di un soggetto affetto da linfoma vitreoretinico primario. Sono evidenti gli infiltrati linfomatosi sia nella foto a colori (A), che in autofluorescenza (B) che in fluorangiografia (C).