Negli ultimi anni la metodica nota come optical coherence tomography angiography (OCTA) ha aperto nuove strade nell’imaging in oftalmologia. Si tratta di una tecnica diagnostica non invasiva basata sul calcolo del coefficiente di decorrelazione tra acquisizioni OCT ottenute consecutivamente, al fine di sfruttare il segnale di elementi in movimento (globuli rossi) per ricostruire il decorso dei vasi sanguigni. Mediante questa metodica è possibile studiare il network vascolare retinico sia in condizioni fisiologiche che patologiche, evidenziandone eventuali anomalie. I miglioramenti tecnici, tutt’ora in corso, sono stati conseguiti grazie alla costruzione di tomografi sempre più avanzati, così come allo sviluppo di algoritmi di post-processing in grado di elaborare con sempre maggiore accuratezza il segnale.
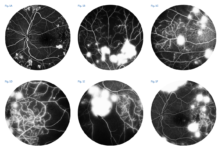
In ambito fisiologico, le nuove metodiche OCTA consentono di effettuare uno studio accurato dei plessi vascolari retinici superficiale e profondo, nonché della giunzione coriocapillare (1). In contesti patologici, l’OCTA si è rivelata essere un utile strumento per la valutazione di numerose anomalie; tra queste la neovascolarizzazione coroideale (CNV) (2), un processo patologico associato a numerose patologie, come la degenerazione maculare legata all’età e la degenerazione maculare miopica, il quale porta alla formazione di neovasi, funzionalmente incompetenti, i quali possono determinare fenomeni essudativi a livello retinico, con un conseguente impatto negativo sulla visione. Le metodiche finora utilizzate per lo studio di tali lesioni prevedevano approcci invasivi, comprendenti l’iniezione di coloranti, come la fluoroangiografia e l’angiografia con verde d’indocianina (Fig. 1);
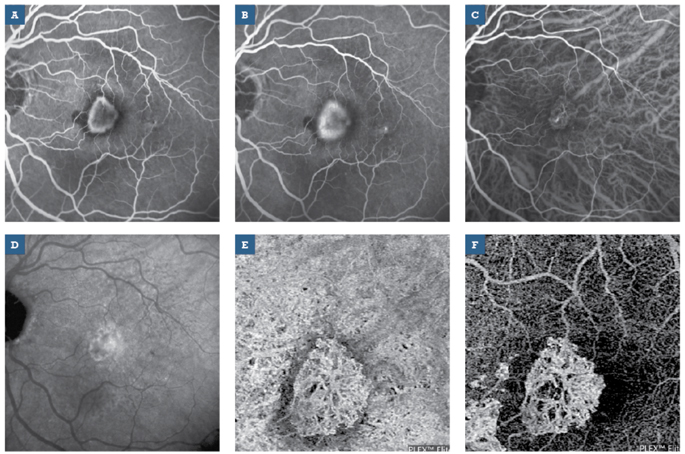
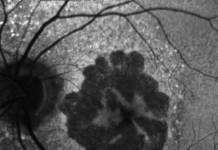
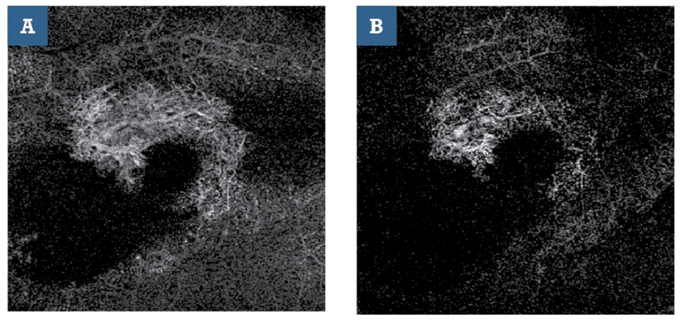
il razionale di tali approcci, a tutt’oggi importanti nella diagnostica retinica, è quello di evidenziare i segni di tali vasi incompetenti, rappresentati da diffusione del colorante al di fuori del compartimento vascolare. In questo contesto, l’OCTA si è rivelata essere un strumento diagnostico utile, non invasivo e facilmente riproducibile per lo studio delle CNV (3). La facilità di esecuzione, abbinata ad un basso disagio per i pazienti ed alla più estesa applicabilità in ambito clinico (per esempio pazienti allergici o nefropatici) rende l’OCTA un valido strumento per eseguire uno stretto monitoraggio dei pazienti affetti da CNV, permettendo inoltre di valutare con precisione gli effetti a breve e medio-lungo termine dell’iniezione intravitreali di farmaci, come gli anti-VEGF, a scopo di trattamento (4) (Fig. 2).

Inoltre, la possibilità di effettuare analisi non solo morfologiche ma anche quantitative, contribuisce ad incrementare notevolmente il potenziale diagnostico di OCTA (5); è infatti possibile effettuare una serie di misurazioni confrontabili nel tempo della densità vascolare retinica, tracciare un profilo preciso del processo di neovascolarizzazione in atto, nonché monitorare e valutare gli effetti di trattamenti diversi sulla patologia. Considerazioni simili possono essere fatte nei riguardi della retinopatia diabetica, per la quale l’OCTA si è rivelato essere un valido approccio per una approfondita valutazione dei plessi vascolari retinici (6); ha permesso inoltre di effettuare una migliore valutazione dei margini della regione avascolare foveale, se comparata all’angiografia con fluoresceina (7). L’OCTA sta trovando rapidamente impiego in una vasta gamma di altre patologie oftalmologiche, come il glaucoma (8), le occlusioni venose retiniche (9,10) e la miopia elevata (11).
Sebbene siano già numerosi i risultati ottenuti con l’OCTA, la ricerca scientifica sta continuando a lavorare al fine di conseguire nuovi ed importanti miglioramenti sia per quanto riguarda l’acquisizione che l’elaborazione di tali informazioni. Da una parte, un obiettivo posto riguarda lo sviluppo di nuove e più accurate tecniche di segmentazione in grado di visualizzare con maggior sensibilità e specificità le strutture vascolari retiniche. Tale sviluppo porterà sia ad una migliore individuazione dei plessi vascolari retinici superficiale e profondo, già analizzabili in modo efficace, sia alla completa e definitiva ricostruzione del terzo plesso vascolare retinico, denominato plesso intermedio. Quest’ultimo, precedentemente descritto con metodiche istologiche (12), manca di un risultato conclusivo circa la sua individuazione dal punto di vista dell’imaging, nonostante alcuni tentativi eseguiti da parte di diversi autori (13,14).
Dall’altra parte, una interessante prospettiva di sviluppo riguarda lo sfruttare il segnale OCTA per scopi funzionali; ad oggi, infatti, il segnale OCTA, di per sé dinamico in quanto ottenuto dall’analisi del movimento dei globuli rossi, viene pressoché esclusivamente utilizzato per ottenere la ricostruzione della morfologia vascolare. Muoversi sul versante funzionale permetterà di realizzare valutazioni su come effettivamente si verifica la perfusione retinica, in termini sia di efficacia che di velocità; inoltre sarà possibile classificare processi patologici come la CNV a seconda del loro grado di attività. Per realizzare ciò sarà necessario superare diversi attuali ostacoli, come i limiti di risoluzione delle attuali metodiche OCTA e la ridotta sensibilità nel rilevare flussi sanguigni troppo lenti o troppo rapidi.
In conclusione, sebbene le prospettive di miglioramento siano molteplici, vi è largo accordo nel considerare l’OCTA una tecnica facilmente eseguibile nella pratica clinica, in grado di ridurre notevolmente l’esecuzione di esami invasivi con iniezione di agenti coloranti e di fornire dati molto accurati in numerosi contesti patologici.
Bibliografia
- de Carlo TE, Romano A, Waheed NK, Duker JS. A review of optical coherence tomography angiography (OCTA). Int J Retina Vitreous. 2015;1:5.
- Carnevali A, Cicinelli MV, Capuano V, Corvi F, Mazzaferro A, Querques L, Scorcia V, Souied EH, Bandello F, Querques G. Optical Coherence Tomography Angiography: A Useful Tool for Diagnosis of Treatment-Naïve Quiescent Choroidal Neovascularization. Am J Ophthalmol. 2016;169:189-98. doi: 10.1016/j.ajo.2016.06.042
- Costanzo E, Miere A, Querques G, Capuano V, Jung C, Souied EH.Type 1 Choroidal Neovascularization Lesion Size: Indocyanine Green Angiography Versus Optical Coherence Tomography Angiography. Invest Ophthalmol Vis Sci. 2016;57(9):OCT307-13. doi: 10.1167/iovs.15-18830
- Parravano M, Querques L, Scarinci F, Giorno P, De Geronimo D, Gattegna R, Varano M, Bandello F, Querques G. Optical coherence tomography angiography in treated type 2 neovascularization undergoing monthly anti-VEGF treatment. ActaOphthalmol. 2016. doi: 10.1111/aos.13180
- Querques L, Giuffrè C, Corvi F, Zucchiatti I, Carnevali A, De Vitis LA, Querques G, Bandello F. Optical coherence tomography angiography of myopic choroidal neovascularisation. Br J Ophthalmol. 2016. pii: bjophthalmol-2016-309162. doi: 10.1136/bjophthalmol-2016-309162
- Miwa Y, Murakami T, Suzuma K, Uji A, Yoshitake S, Fujimoto M, Yoshitake T, Tamura Y, Yoshimura N.Relationship between Functional and Structural Changes in Diabetic Vessels in Optical Coherence Tomography Angiography. Sci Rep. 2016;6:29064. doi: 10.1038/srep29064
- Soares M, Neves C, Marques IP, Pires I, Schwartz C, Costa MÂ, Santos T, Durbin M, Cunha-Vaz J.Comparison of diabetic retinopathy classification using fluorescein angiography and optical coherence tomography angiography. Br J Ophthalmol. 2017;101(1):62-68. doi: 10.1136/bjophthalmol-2016-309424
- Rao HL, Kadambi SV, Weinreb RN, Puttaiah NK, Pradhan ZS, Rao DA, Kumar RS, Webers CA, Shetty R. Diagnostic ability of peripapillary vessel density measurements of optical coherence tomography angiography in primary open-angle and angle-closure glaucoma. Br J Ophthalmol. 2016. pii: bjophthalmol-2016-309377. doi: 10.1136/bjophthalmol-2016-309377
- Kang JW, Yoo R, Jo YH, Kim HC.Correlation of microvascular structures on optical coherence tomography angiography with visual acuity in retinal vein occlusion.Retina. 2016.
- Suzuki N, Hirano Y, Tomiyasu T, Esaki Y, Uemura A, Yasukawa T, Yoshida M, Ogura Y.Retinal Hemodynamics Seen on Optical Coherence Tomography Angiography Before and After Treatment of Retinal Vein Occlusion. Invest Ophthalmol Vis Sci. 2016;57(13):5681-5687. doi: 10.1167/iovs-16-20648
- Li M, Yang Y, Jiang H, Gregori G, Roisman L, Zheng F, Ke B, Qu D, Wang J.Retinal microvascular network and microcirculation assessments in high myopia. Am J Ophthalmol. 2016. pii: S0002-9394(16)30531-1. doi: 10.1016/j.ajo.2016.10.018
- Chan G, Balaratnasingam C, Yu PK, Morgan WH, McAllister IL, Cringle SJ, Yu DY. Quantitative morphometry of perifoveal capillary networks in the human retina. Invest Ophthalmol Vis Sci. 2012;53(9):5502-14. doi: 10.1167/iovs.12-10265
- Park JJ, Soetikno BT, Fawzi AA. Characterization of the middle capillary plexus using optical coherence tomography angiography in healthy and diabetic eyes. Retina. 2016;36(11):2039-2050.
- Hwang TS, Zhang M, Bhavsar K, Zhang X, Campbell JP, Lin P, Bailey ST, Flaxel CJ, Lauer AK, Wilson DJ, Huang D, Jia Y.Visualization of 3 Distinct Retinal Plexuses by Projection-Resolved Optical Coherence Tomography Angiography in Diabetic Retinopathy. JAMA Ophthalmol. 2016;134(12):1411-1419. doi: 10.1001/jamaophthalmol.2016.4272