Qualsiasi infezione corneale deve essere considerata un'emergenza oftalmologica, in quanto può determinare un'alterazione dell'integrità anatomica del bulbo oculare fino alla perforazione, con conseguente endoftalmite; bisogna inoltre considerare che i casi di cheratite o di ulcera corneale guariti dal punto di vista microbiologico possono dare luogo ad opacità dello stroma corneale con riduzione permanente della capacità visiva (1). Gli esiti di tali infezioni rappresentano tuttora nel mondo la quarta causa di cecità e sono responsabili del 10% delle cause di deterioramento visivo nei Paesi in via di sviluppo.
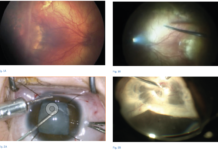
Le infezioni corneali determinano caratteristicamente infiammazione e infiltrati corneali, con o senza difetti epiteliali (figura 1), e sono riconducibili a quattro principali categorie di agenti microbiologici: batteri, miceti, virus e parassiti, di cui il più comune è l'acanthamoeba.
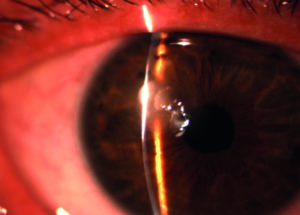
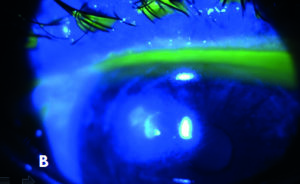
Fisiologicamente il sistema superficie oculare mantiene condizioni di omeostasi atte a preservare la cornea dall'invasione di agenti patogeni. Una fondamentale funzione protettiva è svolta dalle palpebre e dal film lacrimale, grazie alla presenza di linfociti, immunoglobuline, lisozima, lattoferrina, betalisina, ceruloplasmina, complemento, interleuchine ed altre sostanze con funzione antimicrobica. Le lacrime esercitano inoltre una continua attività di lavaggio e di diluizione su qualsiasi sostanza estranea. Queste strutture, assieme alla flora batterica saprofita, svolgono un importante gioco di squadra che previene e contiene lo sviluppo di infezioni.
Il sopraggiungere di una noxa esogena o endogena può minare questo equilibrio e determinare l'insorgere dell'infezione (2). Nella tabella 1 sono riportati i principali fattori di rischio per lo sviluppo di un'infezione della cornea.
La diagnosi si avvale innanzitutto di una accurata anamnesi, con particolare attenzione a precedenti traumatismi o patologie della congiuntiva. L'esame clinico prosegue con la determinazione dell'acuità visiva, con la valutazione della cornea alla lampada a fessura, anche con l'uso di fluoresceina, e un accurato esame della superficie oculare, valutando in particolare palpebre, congiuntiva, sensibilità della cornea, film lacrimale, eventuale interessamento della camera anteriore (4).
Forme a ezio-patogenesi batterica
La causa più frequente di cheratite è l'infezione batterica. La cornea può essere aggredita da numerosissime specie batteriche, oltre l'80% delle quali sono riconducibili a quattro principali gruppi: micrococchi, streptococchi, pseudomonas ed enterobacteriaceae (5). I germi in genere penetrano nel tessuto corneale grazie a lesioni della barriera epiteliale; all'interno dello stroma corneale il danno è mediato dalle esotossine, prodotte sia dai gram positivi che dai Gram negativi, da enzimi rilasciati nel tessuto (proteasi, coagulasi, collagenasi, lipasi), dalle endotossine, nel caso di batteri Gram negativi, e dalla stessa risposta infiammatoria del tessuto ospite. Alcuni batteri sono in grado di penetrare nei tessuti profondi della cornea anche in assenza di lesioni epiteliali preesistenti: il gonococco, il corynebacterium diphteriae, l'haemophilus aegyptius e la listeria monocytogenes; si tratta di specie molto aggressive, fortunatamente meno diffuse alle nostre latitudini (5, 6).
Dal punto di vista clinico, le ulcere e gli infiltrati da Gram positivi hanno in genere minore estensione e confini più definiti rispetto a quelli da Gram negativi, che determinano più marcata e rapida tendenza alla suppurazione, con essudati aderenti e necrosi stromale (7).
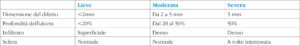
La gravità dell'infezione è legata all'ampiezza e alla profondità delle lesioni corneali e all'eventuale coinvolgimento sclerale (8), come rappresentato in tabella 2.
Ai fini terapeutici è anche fondamentale distinguere le forme settiche da quelle sterili, legate a cause non infettive, quali malattie del collageno, sindrome sicca, reazioni immuno-allergiche e alterazioni neurotrofiche. Le infiammazioni sterili sono generalmente più periferiche, meno estese, con ridotta reazione ciliare e difetti epiteliali meno estesi; sono associate inoltre ad una sintomatologia dolorosa meno intensa e a minore fotofobia, rispetto a quelle su base infettiva (9).
La diagnosi eziologica delle forme batteriche può essere confermata all'esame microscopico diretto del raschiato corneale, colorato con Gram o Giemsa. L'esame a fresco ha il vantaggio di offrire un rapido orientamento diagnostico nelle forme batteriche e in quelle micotiche; la metodica Gram, correttamente eseguita, consente di riconoscere l'agente causale nel 60-75% delle forme batteriche e nel 40-85% di quelle da miceti (10).
Gli esami colturali richiedono alcuni giorni per ottenere un risultato attendibile, ma hanno il vantaggio di consentire l'esecuzione dell'antibiogramma e quindi di individuare la terapia più efficace. Purtroppo non sempre è possibile individuare l'agente causale, per una scarsa carica nel prelievo o per effetto di terapie già in corso, che possono ostacolare lo sviluppo del germe, anche se vengono adottate particolari precauzioni, quali l'uso di resine adsorbenti o una breve sospensione della terapia antimicrobica (11).
Infezioni da miceti, protozoi e virus
Le infezioni fungine sono dovute in genere alla candida, micete lievitiforme molto diffuso, o a forme filamentose, in particolare fusarium e aspergillus. Determinano generalmente ulcerazione del tessuto e lo sviluppo di reazioni suppurative, in presenza di lesioni epiteliali e di una riduzione dei meccanismi di difesa dell'ospite o in seguito a traumatismi di origine vegetale. Il decorso è sub-acuto, con formazione di infiltrati stromali profondi ed ipopion; i margini sono in genere rilevati, irregolari ed indistinti; a volte si rilevano caratteristici focolai satelliti (12, 13). L'identificazione dell'agente infettivo può essere effettuata sul raschiato dai margini della lesione o prelevato dalla congiuntiva e colorato in May-Grumwald Giemsa; colorazioni più specifiche sono l'idrossido di potassio e l'argento metenamina di Gomori oppure il bianco calcofluor, per l'osservazione in microscopia a fluorescenza (14). Le colture per miceti vengono allestite con terreno Sabouraud e, in caso di positività, sottoposte ad antimicogramma (15).
L'acanthamoeba è un protozoo praticamente ubiquitario, presente in una forma attiva, detta trofozoite, o come cisti; colonizza la cornea in condizioni particolari, soprattutto nei portatori di lenti a contatto, determinando in genere un'intensa sintomatologia dolorosa, lacrimazione, fotofobia e riduzione del visus (16).
Il protozoo si ancora alla superficie corneale grazie a molecole di adesione (Mannose Binding Protein) ed esercita un effetto citotossico e litico grazie alla produzione di metallo-proteinasi ed altre proteasi.
Con la propagazione dell'infezione si formano infiltrati densi, con tipica disposizione radiale o ad anello; le lesioni possono evolvere verso il melting corneale, fino alla perforazione (17, 18).
La diagnosi può essere confermata con esame microscopico su preparati a fresco, colorati con bianco calcofluor, Giemsa, ematossilina eosina o wright. Le colture richiedono particolari allestimenti e tempi prolungati, per cui non sono sempre praticabili. Altre metodiche di indagine sono la microscopia confocale della cornea, in presenza di una sufficiente trasparenza del tessuto, e l'identificazione del patogeno con metodica PCR (Polymerase Chain Reaction) (19).
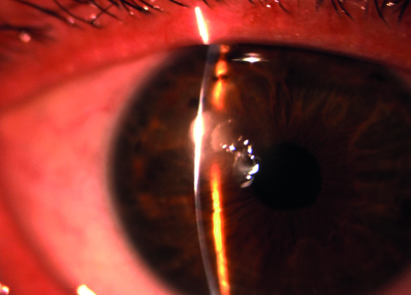
Tra le infezioni virali, le più significative sono quelle da Herpesviridae, che possono interessare l'epitelio, lo stroma o anche l'endotelio corneale. Sono forme certamente sottostimate, essendo molto frequente nella popolazione la presenza del virus nei gangli nervosi, in stato quiescente, e la possibilità di una sua riattivazione con sviluppo delle lesioni corneali in seguito all'intervento di fattori esogeni o endogeni, soprattutto in coincidenza con un calo delle difese immunitarie. La presentazione clinica permette un agevole riconoscimento delle forme tipiche, in presenza ad esempio di una lesione dendritica; in altri casi il criterio clinico non permette di formulare una diagnosi differenziale, anche per la possibile associazione con altre infezioni (20).
In molti casi di dubbia eziologia è possibile pervenire all'identificazione dell'agente infettivo con tecniche a immunofluorescenza e, in maniera più specifica, con la metodica PCR, che offre una elevata sensibilità diagnostica nelle forme virali e da chlamydie, anche in presenza di una ridotta carica infettiva (21).
Nei casi in cui la trasparenza della cornea sia sufficientemente conservata è possibile ottenere informazioni preziose con una microscopia confocale in vivo, che può essere risolutiva soprattutto nelle forme da parassiti e in quelle fungine; si tratta tuttavia di una metodica operatore-dipendente, i cui risultati sono legati in buona misura all'esperienza dell'esaminatore (22).
Nuove frontiere
Nonostante la disponibilità di numerose opzioni diagnostiche, l'agente causale delle infezioni resta spesso misconosciuto. Recenti studi hanno mostrato che in molti casi di cheratite con negatività dei comuni esami microbiologici, è stato possibile evidenziare l'agente causale esaminando il raschiato della congiuntiva tarsale superiore in microscopia elettronica a scansione (SEM) (23, 24).
Il criterio morfologico e le dimensioni consentono di rilevare in microscopia elettronica patogeni di non facile identificazione, quali l'acanthamoeba (figura 2), micobatteri e micrococchi (figura 3), miceti e chlamydia.



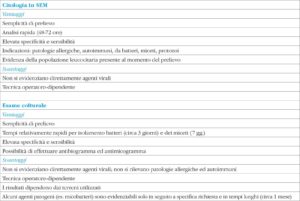
La microscopia elettronica a scansione evidenzia anche la risposta immunologica del paziente; le caratteristiche dell'infiltrato infiammatorio consentono un orientamento diagnostico anche nelle forme allergiche ed autoimmuni, oltre che in quelle infettive (25). Nella tabella 3 sono riportati i vantaggi e i limiti della metodica, in confronto con i tradizionali esami colturali.
In definitiva, è necessario tenere presente che le infezioni della cornea rappresentano tuttora una condizione seria, di non sempre agevole diagnosi, potenziale causa di gravi complicanze. L'esperienza clinica maturata in centri di riferimento e la disponibilità delle varie metodiche di indagine consente di pervenire nella maggioranza dei casi ad una diagnosi eziologica, che rappresenta il presupposto essenziale per un approccio terapeutico mirato e realmente efficace.