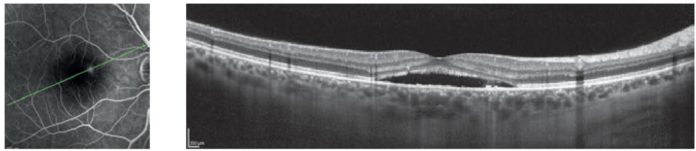
La corioretinopatia sierosa centrale (CSC) è la quarta retinopatia non chirurgica più comune dopo la degenerazione maculare legata all’età, la retinopatia diabetica e le occlusioni venose (1). Appartenente allo spettro dei disordini retinici associati alla pachicoroide, è caratterizzata non solo da una coroide di spessore aumentato, ma anche da una sua maggiore permeabilità e dalla presenza di vasi coroideali di dimensioni maggiori (i cosiddetti “pachyvessels”).
Nel dettaglio, la CSC è caratterizzata da distacchi sierosi della retina neurosensoriale, che si possono accompagnare a distacchi focali dell’epitelio pigmentato. Questo comporta sintomi nella parte centrale del campo visivo, quali una riduzione del visus, visione distorta, scotoma centrale e alterazione della visione dei colori. L’età di insorgenza della malattia è variabile, con un picco intorno ai 40-50 anni e il genere maggiormente colpito è quello maschile.
Tra i fattori di rischio associati alla CSC ricordiamo l’utilizzo di terapia corticosteroidea, condizioni che si associano ad un aumento del cortisolo endogeno, come ad esempio la malattia di Cushing e la gravidanza, l’ipertensione, il fumo, la sindrome delle apnee ostruttive del sonno, un pattern di personalità di tipo A, la sindrome da reflusso gastroesofageo, l’infezione da H. Pylori e la terapia con alcuni MEK-inibitori (2).
La maggior parte dei distacchi del neuroepitelio è idiopatico e si risolve spontaneamente nel giro di 3-4 mesi (forma acuta) con buona prognosi visiva, ma fino al 50% dei pazienti può andare incontro a recidiva entro un anno. Infine, alcuni pazienti sono affetti da una forma cronica di malattia con prognosi visiva peggiore e persistenza dei distacchi sierosi retinici, maggiormente correlata a complicanze come atrofia retinica e/o sviluppo di neovascolarizzazioni maculari (MNV) (3).
La patogenesi della malattia rimane ad oggi poco conosciuta; si pensa che siano coinvolti plurimi meccanismi, tra cui l’ispessimento coroideale e l’aumentata permeabilità vasale, con conseguente disfunzione dell’epitelio pigmentato retinico e trasudazione di fluido a livello sottoretinico. Recentemente, nuove ricerche hanno dimostrato il potenziale coinvolgimento del pathway del recettore dei mineralcorticoidi nella patogenesi della CSC (4).
Diagnosi
Dal punto di vista diagnostico, l’OCT (enhanced-depth OCT o EDI-OCT) dimostra l’accumulo fluido sottoretinico e i distacchi dell’epitelio pigmentato retinico, l’aumentato spessore coroideale con congestione e dilatazione dei grossi vasi coroideali. In occhi con CSC acuta, l’autofluorescenza può identificare nessun segno o minime aree di iperautofluorescenza nell’area coinvolta dal distacco sottoretinico. Nella CSC cronica, il pattern di autofluorescenza è più eterogeneo, andando da forme di iperautofluorescenza gravitazionale o focale da rimaneggiamento dell’EPR, a forme di ipoautofluorescenza da danneggiamento/atrofia dell’EPR.
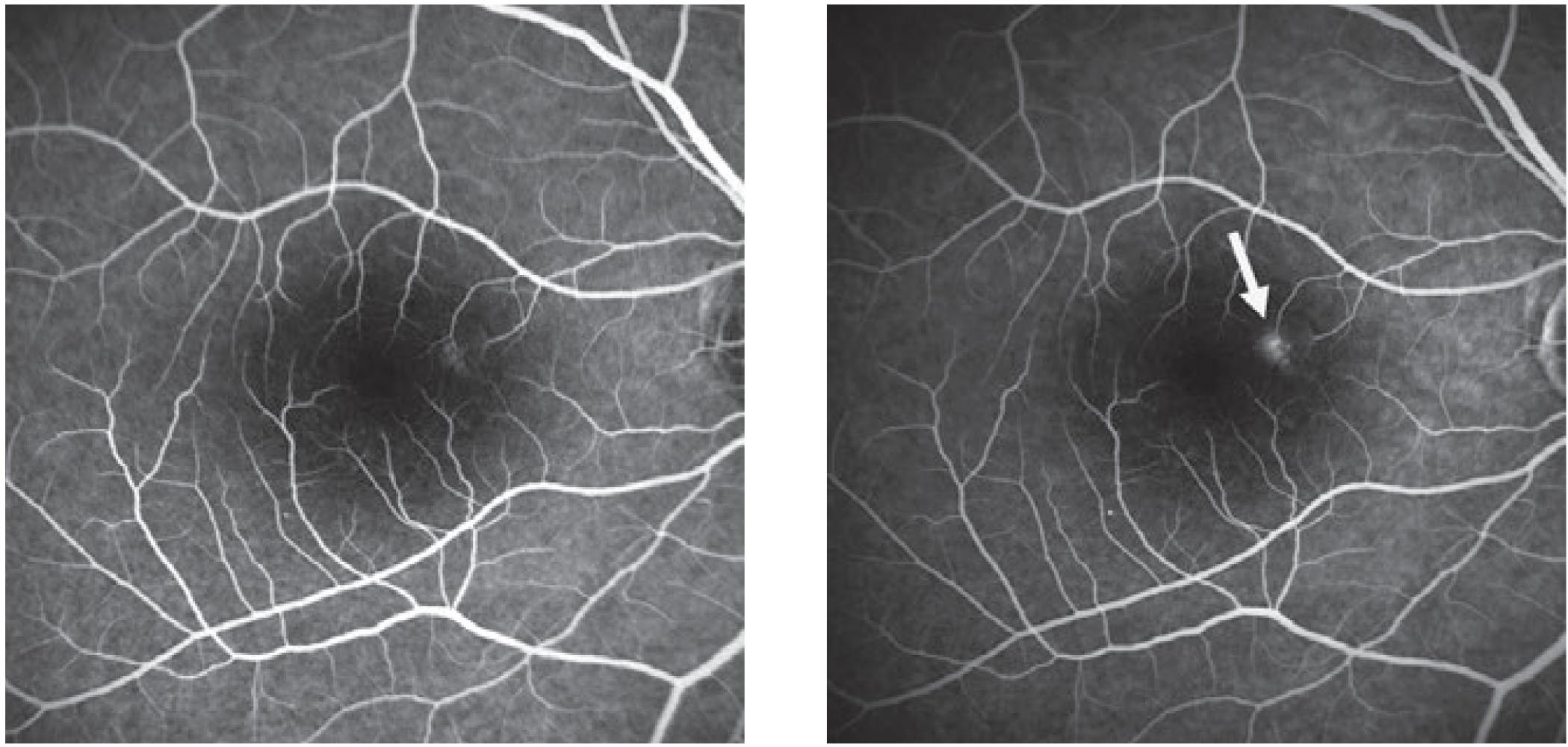
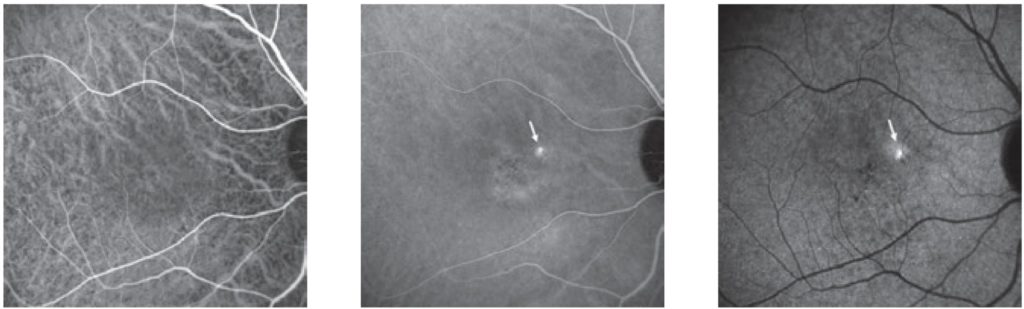
Per quanto riguarda la fluorangiografia, la CSC presenta classicamente un aspetto “a macchia di inchiostro” o “a fumo di ciminiera”. Le forme croniche presentano una iperfluorescenza legata ad un effetto finestra nelle aree di atrofia. L’iperpermeabilità della coroide, probabilmente dovuta a stasi, ischemia o infiammazione, si evidenzia infine come staining coroideale nelle fasi intermedie dell’ICGA. L’ICGA consente, inoltre, di evidenziare il tipico spot iper-cianescente, segno di attività della malattia, e rilevare la MNV, comune complicanza di fase tardiva di malattia (5).
L’obiettivo del trattamento della CSC è la preservazione degli strati retinici esterni e l’eliminazione completa del distacco sieroso del neuroepitelio, in quanto anche una piccola quantità di fluido
sotto-retinico può portare ad un danno irreversibile dei fotorecettori
Opzioni terapeutiche
L’obiettivo del trattamento della CSC (3) è la preservazione degli strati retinici esterni e l’eliminazione completa del distacco sieroso del neuroepitelio, in quanto anche una piccola quantità di fluido sotto-retinico può portare ad un danno irreversibile dei fotorecettori (6,7,8). Idealmente, il trattamento dovrebbe prevenire le recidive di malattia e la progressione del danno.
Come prima misura, è importante individuare ed eliminare la presenza degli eventuali fattori di rischio, come ad esempio l’assunzione di qualsiasi forma di corticosteroidi. Spesso, inoltre, è consigliato un miglioramento dello stile di vita, in particolare l’eliminazione di fattori stressanti.
Tra gli approcci terapeutici proposti, citiamo la fotocoagulazione laser, al fine di “chiudere” i difetti a livello della barriera emato-retinica esterna individuati mediante l’esame fluorangiografico. Nonostante la risposta anatomica in termini di scomparsa del fluido sottoretinico sia piuttosto elevata, questo non si riflette in un sostanziale miglioramento dell’acuità visiva (9). Per di più, il trattamento fotocoagulativo porta con sé il rischio, seppur non frequente, di sviluppo di neovascolarizzazioni (9, 10).
Il laser micropulsato sottosoglia adopera cicli di impulsi laser con lo scopo di permettere la dissipazione del calore tissutale tra un impulso e l’altro, senza mai raggiungere il valore critico che porterebbe alla denaturazione proteica e pertanto senza lasciare “cicatrici” a livello retinico (11,12): si pensa infatti che l’effetto del laser si esplichi attraverso l’induzione delle cosiddette heat shock protein, consentendo un ripristino delle funzioni dell’EPR ed un conseguente riassorbimento del liquido sottoretinico (13). Il settaggio del laser micropulsato sottosoglia è piuttosto variegato negli studi presenti in letteratura, inoltre non sono presenti trial prospettici randomizzati controllati capaci di confrontare le diverse impostazioni. Per tale motivo risulta difficile una valutazione comprensiva dell’utilizzo di tale metodica; ciononostante vi sono diverse testimonianze positive del suo utilizzo nel trattamento della CSC (11, 14, 15).
Un ulteriore approccio possibile è rappresentato dalla terapia fotodinamica (PDT), che sfrutta la stimolazione laser dei vasi coroideali a livello del focus di leakage dopo infusione sistemica di verteporfina (16). I protocolli più utilizzati, senza una reale superiorità di una modalità sull’altra, sono quello half-dose e half-fluence, che utilizzano, rispettivamente, metà della dose di verteporfina e metà della fluenza del laser rispetto al settaggio standard originariamente utilizzato per il trattamento delle MNV in corso di degenerazione maculare senile (17). Nonostante un possibile peggioramento transitorio del quadro clinico nelle settimane successive al trattamento, la PDT permette nella maggior parte dei casi una riduzione sostanziale del fluido sottoretinico e della sintomatologia del paziente, attraverso il rimodellamento della coriocapillare sottostante il difetto dell’EPR (18, 19).
Approcci più invasivi quali l’utilizzo di iniezioni intravitreali di anti-VEGF, seppur siano stati sperimentati nelle forme non complicate di CSC, sono ad oggi primariamente utilizzati in caso di comparsa di neovascolarizzazioni maculari (10, 20, 21, 22).
Terapia medica
La terapia medica è un’altra strategia che è stata largamente sperimentata nel trattare la CSC. Tra i vari farmaci, gli antagonisti dei mineralcorticoidi sono tra i più utilizzati. L’eplerenone, un antagonista dell’aldosterone ampiamente studiato relativamente al profilo di azione e sicurezza, è tra i più noti nella pratica clinica oculistica nel trattamento della CSC.
L’attuale schema terapeutico prevede, nella prima settimana, una posologia di 25 mg/die, con monitoraggio della potassiemia (intervallo di riferimento 3,5-5 meq/L) e successivo passaggio ad un dosaggio di 50 mg/die nelle settimane seguenti, se la potassiemia dosata dovesse risultare nei valori di norma.
Recenti studi, mirati ad implementare le conoscenze sulla CSC, si sono concentrati sui mineralcorticoidi (es. aldosterone), ormoni che causano movimento di acqua grazie all’attivazione di trasportatori ionici (Na+, K+). Basandosi su occhi di topo, Zhao et al hanno messo in evidenza la presenza di recettori dei mineralcorticoidi sulle cellule dell’EPR e dei vasi della coroide (23,24), dimostrando inoltre una loro iper-attivazione (24), condizione che potrebbe causare accumulo di fluido sottoretinico. Su questa scia, Bousquet et al (23), in uno studio pilota prospettico, per primi hanno sperimentato l’eplerenone su 13 pazienti affetti da CSC refrattaria ad altri trattamenti. Numerosi altri studi retrospettivi, prospettici ed alcuni si sono susseguiti nel tentativo di dare risposte al dubbio sull’efficacia del diuretico nella CSC. Una meta-analisi ha raccolto i dati di 5 trial randomizzati (25) ed ha evidenziato un miglioramento dell’acuità visiva in chi assumeva eplerenone rispetto al gruppo di controllo ad uno e due mesi dall’inizio della terapia, ed una riduzione del fluido sottoretinico maggiore nel braccio eplerenone rispetto al braccio placebo evidente ad un mese ma non confermato ai due mesi.
Lotery et al (26) hanno recentemente presentato su Lancet i risultati del VICI-trial, lavoro che ha confrontato in doppio-cieco l’effetto dell’eplerenone sull’acuità visiva a 12 mesi in pazienti con CSC da almeno 4 mesi, aumentando così la finestra temporale di osservazione sull’efficacia del farmaco rispetto al placebo. A 12 mesi gli autori non hanno evidenziato una differenza statisticamente significativa nei due gruppi in termini di acuità visiva, rimarcando la non utilità dell’eplerenone nel trattamento della CSC cronica. Alcuni dubbi sulla metodologia del trial clinico sono insorti nella comunità scientifica e Sacconi et al (27) hanno indirizzato una lettera agli autori del VICI-trial. I punti principali di obiezione sono stati i seguenti:
- il gruppo placebo è stato trattato con PDT in percentuale maggiore rispetto al gruppo di trattamento (13% vs 5%, rispettivamente) durante la durata del trial clinico. L’ipotesi è che questa differenza tra i due gruppi abbia influenzato i risultati, visto che l’efficacia della PDT sulla CSC cronica è ormai validata da numerosi studi (28,29,30).
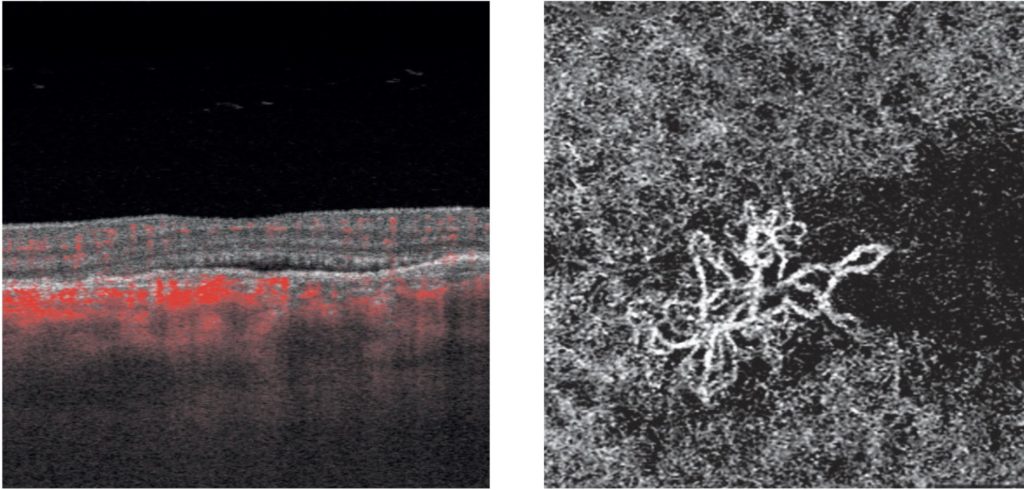
- La presenza di neovascolarizzazione coroideale che complica casi di CSC è il principale fattore predittivo negativo della risposta all’eplerenone (31). Lotery et al hanno diagnosticato MNV solo tramite OCT ed angiografia (FA ed ICGA), metodi che non diagnosticano le MNV in un terzo dei casi e che sono meno sensibili, da soli, rispetto a quando sono affiancati da OCTA (32). Non avendo utilizzato l’OCTA, è ipotizzabile l’inclusione di diversi pazienti affetti da neovascolarizzazione coroideale.
Futuri trial sono necessari per validare o confutare definitivamente l’utilizzo dell’eplerenone nei pazienti con CSC. La PDT ha sicuramente il vantaggio di essere consolidata da numerosi trial clinici, ma ha lo svantaggio di essere costosa ed invasiva. Sebbene al momento non esista un consenso sullo standard di trattamento per la CSC cronica, la PDT appare ancora come la più affidabile opzione in prima linea.
La terapia medica è un’altra strategia che è stata largamente sperimentata nel trattare la CSC. Tra i vari farmaci, gli antagonisti dei mineralcorticoidi sono tra i più utilizzati