INTRODUZIONE
La degenerazione maculare legata all’età (AMD) è la principale causa di grave compromissione visiva nelle persone anziane nei paesi industrializzati (1-3). La forma essudativa è caratterizzata dall’insorgenza di lesioni neovascolari coroideali (CNV), che possono essere classificate in base alla dimensione, localizzazione e composizione del processo neovascolare (4).
L’imaging svolge un ruolo fondamentale nella diagnosi e gestione dell’AMD. Precedentemente, l’angiografia con fluoresceina sodica (FA) era considerata il gold standard per la definizione delle caratteristiche delle lesioni e per la diagnosi differenziale nell’AMD di tipo essudativo. Basandosi sull’angiografia, le lesioni neovascolari possono essere classificate in base al pattern di fluorescenza: le lesioni classiche si presentano come aree iperfluorescenti ben demarcate, con evidenza della trama neovascolare nelle fasi precoci dell’esame e leakage del colorante nelle fasi tardive. Le lesioni occulte, invece, si presentano come spots iperfluorescenti con bordi mal definiti nelle fasi precoci dell’angiogramma e leakage tardivo irregolare con un tipico aspetto “a sale e pepe” (5, 6).
Le proliferazioni retiniche angiomatose (RAP) rappresentano una forma distinta di AMD essudativa, solitamente bilaterale e simmetrica, che si verifica più spesso nei pazienti anziani caucasici (7, 8). Questo tipo di neovascolarizzazione è stato per la prima volta descritto da Hartnett e collaboratori come “complesso vascolare retinico profondo anomalo” (9). A differenza degli altri processi neovascolari dell’AMD, nelle RAP il complesso neovascolare è identificato a livello della retina profonda, normalmente priva di vascolarizzazione, ed è alimentato da una o più arteriole retiniche e drenato da una o più venule retiniche. Yannuzzi ha successivamente proposto una classificazione di queste lesioni in 3 stadi: nello stadio 1 si ha una iniziale neovascolarizzazione intraretinica; nello stadio 2 la neovascolarizzazione si estende nello spazio sottoretinico con formazione di anastomosi retino-retinica; nello stadio 3 si ha la formazione di un distacco sieroso dell’epitelio pigmentato retinico e, infine, di un’anastomosi retino-coroideale con sottostante neovascolarizzazione coroideale (7).
È ormai ampiamente riconosciuto che un approccio multi-imaging può essere di grande aiuto nella diagnosi dei diversi tipi di neovascolarizzazioni. L’angiografia dinamica con verde di indocianina (ICGA) è utile nell’accurata diagnosi e staging delle RAP, permettendo di distinguerle da una CNV occulta o minimamente classica (6). Le informazioni dettagliate fornite dalla tomografia a coerenza ottica (SD-OCT) possono essere anch’esse utili nell’identificazione delle RAP e delle manifestazioni cliniche ad esse correlate (10, 11). L’infrarosso (IR) è una metodica di imaging non invasiva sempre più utilizzata nella pratica clinica nella diagnosi di numerose patologie retiniche. Permette di rilevare facilmente la presenza di alcuni segni frequentemente associati con le RAP, in particolare le pseudodrusen reticolari (12-17).
Lo scopo del nostro studio è quello di utilizzare un approccio multi-imaging al fine di identificare i segni clinici che più frequentemente si osservano nelle RAP rispetto agli altri tipi di lesioni neovascolari, facilitando un’appropriata diagnosi differenziale.
MATERIALI E METODI
Si tratta di una studio retrospettivo condotto presso la clinica oculistica dell’ospedale Luigi Sacco, Università di Milano, nel quale si sono analizzate le immagini FA, ICGA, SD-OCT e IR di 30 pazienti con CNV in quadro di AMD. Lo studio è stato eseguito in conformità con gli standard etici fissati dalla Dichiarazione di Helsinki. Le immagini FA, ICGA, SD-OCT e IR sono state acquisite utilizzando Heidelberg HRA + OCT Spectralis (Heidelberg Engineering, Heidelberg, Germany).
Il criterio di inclusione era rappresentato dalla presenza di lesioni neovascolari attive in quadro di AMD (comprendenti lesioni occulte-tipo 1, classiche-tipo 2 e RAP-tipo 3). I criteri di esclusione erano i seguenti: miopia>5D, lesioni neovascolari polipoidali, lesioni neovascolari in strie angioidi o lesioni neovascolari miopiche, infiammatorie o idiopatiche. La diagnosi di RAP è basata sull’evidenza di “hot spots” nelle fasi tardive dell’ICGA e sull’identificazione delle arteriole afferenti e delle venule efferenti e delle associate anastomosi retino-retiniche o retino-coroideali (18). Questa valutazione è stata eseguita da due operatori, reciprocamente mascherati. Successivamente, le immagini FA, ICGA, SD-OCT e IR sono state esaminate da due diversi operatori, anch’essi reciprocamente mascherati tra loro e sul tipo di lesione neovascolare.
Sono state analizzate le immagini FA e ICGA delle fasi precoci e tardive dell’esame e i video dinamici ed è stata valutata la presenza dei seguenti segni:
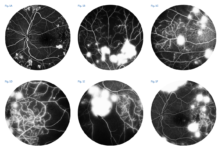
“furto vascolare” da parte della rete neovascolare, definito come attenuazione della parte distale dell’arteriola retinica dopo l’emergenza del vaso afferente alla membrana neovascolare (19) (fig. 1 A, B);
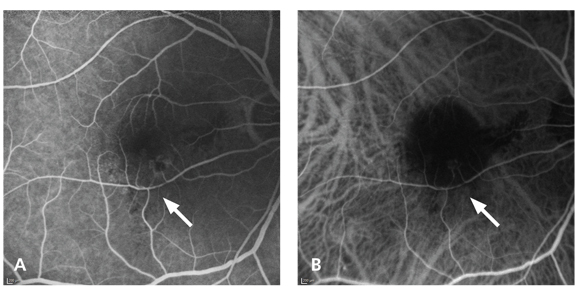
leakage nelle fasi tardive dell’ICGA (20) (fig. 1 C, D).
Le immagini SD-OCT sono state acquisite con una modalità ad alta velocità (768 A-scans per B-scan) in un protocollo di volume costitutito da 19 B-scans. È stata valutata la presenza di:
cisti intraretiniche;
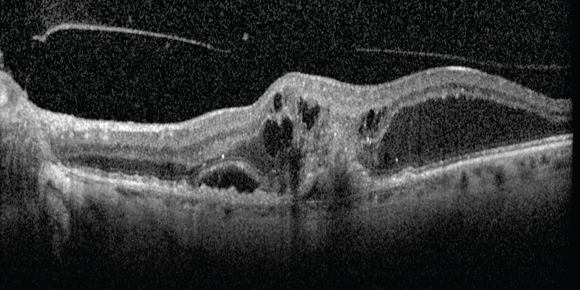
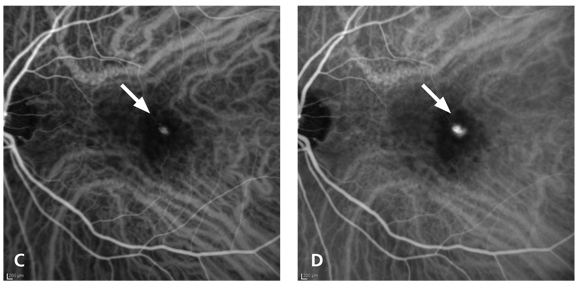
interruzione dell’epitelio pigmentato retinico con la presenza di un’area ovalare iper-riflettente lungo il distacco dell’epitelio pigmentato retinico (11) (fig. 2).
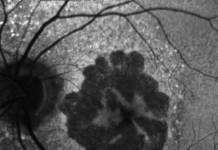
Infine, è stata valutata la presenza di pseudodrusen reticolari, osservabili in SD-OCT come accumuli ben definiti di materiale iper-riflettente al di sopra dell’epitelio pigmentato retinico e in IR come multiple irregolarità di forma tondeggiante od ovale caratterizzate da una ridotta riflettività (21, 22) (fig. 3 A, B).
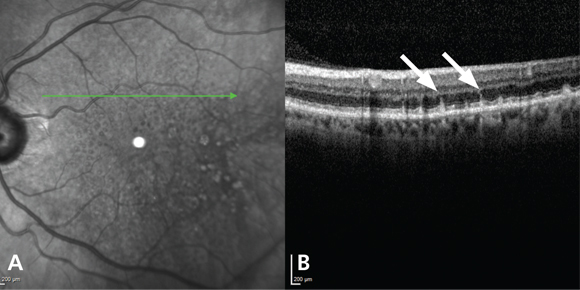
Pseudodrusen reticolari in infrarosso (A) e spectral-domain optical coherence tomography (B) (frecce bianche)
L’analisi statistica è stata eseguita utilizzando un linguaggio R. È stata valutata la variabilità intra e inter osservatore con il calcolo della K di Cohen (k) e l’associazione tra i singoli segni analizzati e il tipo di lesione neovascolare (RAP o altre CNV) attraverso il Fischer’s Exact Test (P<0.05 è indicativo di un’associazione statisticamente significativa). Infine, è stata analizzata una combinazione due a due dei segni più frequentemente associati alla presenza di una lesione di tipo RAP e per ciascuna combinazione è stata calcolata la sensibilità (SE) e la specificità (SP).
RISULTATI
È stato analizzato un solo occhio di ciascuno dei 30 pazienti: 9 casi sono stati classificati come lesioni tipo 1, 5 come lesioni tipo 2 e 16 come lesioni tipo 3. Tutti i pazienti avevano lesioni neovascolari naïve, perciò nessuno era stato precedentemente sottoposto a iniezioni intravitreali di anti-VEGF. Le lesioni neovascolari di tipo 1 e 2 sono state considerate all’interno di un unico gruppo, poiché in entrambi i casi la neovascolarizzazione origina dalla coroide, mentre nello stadio iniziale le lesioni tipo 3 originano dai vasi retinici. L’età media del gruppo delle lesioni tipo 1-2 era di 78 anni (62-93 anni) e l’acuità visiva media era di 0.5 (0.25-0.90); per le lesioni tipo 3 l’età media era di 80 anni (68-90 anni) e l’acuità visiva media era 0.3 (0.16-0.60).
Il “furto vascolare” da parte della rete neovascolare era presente nel 56% dei casi di RAP mentre non è stato riscontrato in nessun caso di lesioni tipo 1-2. Leakage tardivo in ICGA era presente in tutti i casi di RAP; al contrario è stato riscontrato solo nel 7% dei casi negli altri tipi di CNV. Con SD-OCT, le cisti intraretiniche sono state identificate in tutti i casi di RAP e solo nel 14% dei casi nelle lesioni tipo 1-2. L’interruzione dell’epitelio pigmentato retinico con la presenza di un’area ovalare iper riflettente lungo il distacco dell’epitelio pigmentato retinico era evidente nel 93% dei casi di RAP e nel 15% dei casi di lesioni tipo 1-2. Le pseudodrusen reticolari, valutate nell’occhio in studio o nell’occhio controlaterale, erano presenti nell’87% dei casi di RAP e nel 21% dei casi di lesioni tipo 1-2 (tab. 1).
| RAP | ALTRE CNV | p-value* | |
|---|---|---|---|
| Furto vascolare | 0.56 | 0 | < 0.01 |
| Leakage icga | 1 | 0.07 | < 0.01 |
| Edema cistoide | 1 | 0.14 | < 0.01 |
| Interruzione epitelio pigmentato retinico | 0.93 | 0.15 | < 0.01 |
| Pseudodrusen | 0.87 | 0.21 | < 0.01 |
| ICGA: angiografia con verde di indocianina; RAP: retinal angiomatous proliferation; CNV: neovascolarizzazione coroideale. *Fisher’s exact test | |||
Sia l’agreement intra osservatore che quello inter osservatore erano buoni per tutti i segni valutati. In particolare, la concordanza intra osservatore era di 0.87 per il “furto vascolare” e di 1 per il leakage tardivo in ICGA, l’edema cistoide, l’interruzione dell’epitelio pigmentato retinico con la presenza di un’area ovalare iper riflettente e le pseudodrusen. La concordanza inter-osservatore era di 0.92 per il “furto vascolare” e l’interruzione dell’epitelio pigmentato retinico con la presenza di un’area ovalare iper riflettente e di 1 per il leakage tardivo in ICGA, l’edema cistoide e le pseudodrusen (tab. 2). Ciò significa che la valutazione di questi segni è altamente riproducibile.
| Agreement intraosservatore | Agreement interosservatore | p-value* | |
|---|---|---|---|
| Furto vascolare | 0.87 | 0.92 | < 0.01 |
| Leakage icga | 1 | 1 | < 0.01 |
| Edema cistoide | 1 | 1 | < 0.01 |
| Interruzione epitelio pigmentato retinico | 1 | 0.92 | < 0.01 |
| Pseudodrusen | 1 | 1 | < 0.01 |
| ICGA: angiografia con verde di indocianina. *Cohen’s k test | |||
I risultati precedenti mostrano che i 3 segni maggiormente associati alla presenza di una lesione neovascolare di tipo RAP sono: il leakage tardivo in ICGA, la presenza di edema cistoide e di pseudodrusen. La combinazione due a due di questi segni ha dimostrato che la presenza di leakage tardivo in ICGA e di edema cistoide ha una sensibilità e una specificità del 100% (tab. 3). Nel nostro campione, pertanto, la contemporanea presenza di questi due segni si associa alla presenza di una lesione neovascolare di tipo RAP.
| SE | SP | |
|---|---|---|
| Leakage Icga + edema cistoide | 1 | 1 |
| Leakage icga + pseudodrusen | 0.87 | 0.93 |
| Pseudodrusen + edema cistoide | 0.87 | 0.93 |
| ICGA: angiografia con verde di indocianina; SE: sensibilità; SP: specificità | ||
DISCUSSIONE
Questo studio fornisce gli elementi per una migliore diagnosi differenziale tra le RAP e gli altri tipi di lesioni neovascolari nella pratica clinica. Come precedentemente riportato e dimostrato da Viola e collaboratori, le RAP hanno una prognosi funzionale molto scarsa poiché rapidamente progrediscono verso gli stadi più severi, terminando in una cicatrice disciforme (8). La natura aggressiva e la rapida progressione di questo tipo di lesioni neovascolari è stata confermata anche da Gross e collaboratori, i quali avevano valutato il rischio di sviluppare una RAP nell’occhio controlaterale rispetto a quello già interessato (23). Essi dimostrarono che il 40% dei pazienti sviluppavano una RAP nell’occhio controlaterale entro 1 anno, il 56% entro due anni e il 100% entro 3 anni. In un altro studio da noi condotto, avevamo osservato che l’insorgenza di neovascolarizzazione nell’occhio controlaterale avveniva più precocemente nei pazienti con RAP rispetto agli altri tipi di CNV (Bochicchio S, Secondi R, Xhepa A et al. The incidence of neovascularization in the fellow eye of patients with unilateral choroidal neovascularization: a survival analysis, presented at ARVO international meeting, Seattle 2013). Pertanto, una diagnosi precoce di RAP è sicuramente di grande importanza per permettere un trattamento efficace e prevenire una grave perdita visiva. Come dimostrato da Bottoni et al, le RAP negli stadi precoci presentano migliori tassi di chiusura della lesione neovascolare: il 57,1% delle RAP stadio 1 venivano obliterate con successo, mentre solo il 26,2% delle lesioni allo stadio 2 e il 15% allo stadio 3 si erano risolte (24).
L’imaging svolge un ruolo fondamentale per la diagnosi e il trattamento nell’AMD. Precedentemente la FA era considerata il gold standard per la diagnosi di AMD di tipo essudativo. Tuttavia, poiché in alcuni casi la diagnosi differenziale può essere difficoltosa, un approccio multi-imaging può essere di grande aiuto nella migliore determinazione delle caratteristiche delle lesioni. SD-OCT è una tecnica di imaging non invasiva, ad alta risoluzione, che si è dimostrata utile sia nella diagnosi che nel trattamento dei pazienti con AMD: è meno mascherata da sangue o lipidi rispetto all’FA e presenta minori complicazioni sistemiche (6). Inoltre, le informazioni dettagliate fornite dallo SD-OCT permettono di identificare le manifestazioni frequentemente associate alla presenza di una lesione di tipo RAP: neovascolarizzazione intraretinica, distacco dell’epitelio pigmentato retinico, fluido intra o sottoretinico e pseudodrusen reticolari (10, 11). L’ICGA fornisce immagini di alta qualità della circolazione coroideale e può, pertanto, rivelare la presenza di una CNV occulta non visibile in FA. Le proprietà del verde di indocianina e della luce infrarossa aumentano la visualizzazione di strutture al di sotto del sangue, degli essudati o dei distacchi dell’epitelio pigmentato retinico. Inoltre, il verde di indocianina non diffonde in maniera significativa nello spazio sottoretinico o sotto l’epitelio pigmentato retinico, contrariamente alla fluoresceina, fornendo pertanto un maggiore contrasto, necessario per distinguere una RAP da una lesione occulta o minimamente classica (6). L’IR è un’altra tecnica di imaging non invasiva che permette la facile visualizzazione di alcune caratteristiche, come ad esempio e pseudodrusen reticolari (21, 22).
In questo studio abbiamo utilizzato un approccio multi-imaging allo scopo di identificare diversi segni che si verificano più frequentemente nelle RAP rispetto agli altri tipi di CNV. Il “furto vascolare” da parte della rete neovascolare era stato precedentemente descritto da Bottoni e collaboratori (19), i quali avevano sottolineato come il peculiare rimodellamento vascolare nelle RAP sia particolarmente evidente prima del trattamento con triamcinolone acetonide intravitreale e terapia fotodinamica.
SD-OCT è utile nell’identificazione di cisti intraretiniche e dell’interruzione dell’epitelio pigmentato retinico con la presenza di un’area ovalare iper-riflettente lungo il distacco dell’epitelio pigmentato retinico. Quest’ultimo segno è stato precedentemente descritto da Querques e collaboratori (11). In particolare essi avevano descritto i seguenti segni:
“erosion sign”, definito come un’erosione focale dell’epitelio pigmentato retinico lungo un piccolo e localizzato distacco dell’epitelio pigmentato retinico che appare riempito da materiale iper riflettente;
“flap sign”, definito come una rottura focale dell’epitelio pigmentato retinico che lascia due lembi liberi di epitelio pigmentato lungo un piccolo e localizzato distacco dell’epitelio pigmentato retinico;
“kissing sign”, descritto come un’area focale a forma di imbuto di epitelio pigmentato associata ad un’area focale a forma di imbuto rovesciato di neuroepitelio.
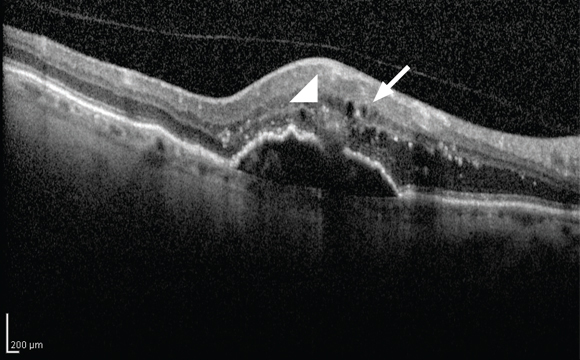
Indipendentemente dalla nomenclatura utilizzata, è tuttavia importante sottolineare che una semplice interruzione dell’epitelio pigmentato retinico senza un’area ovalare iper riflettente può essere osservata anche nelle CNV di tipo classico, poiché esse emergono dalla coroide e vanno ad infiltrare la retina (fig. 4).
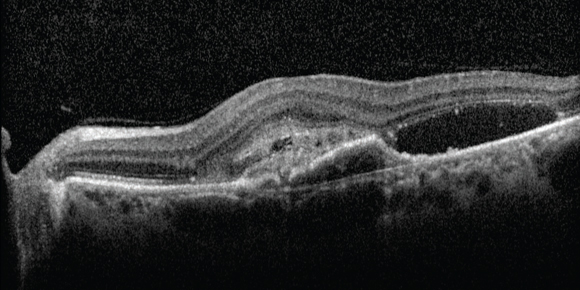
Un altro fattore che può rendere difficoltosa la visualizzazione del sottostante epitelio pigmentato retinico è il mascheramento causato da fluido o essudati (fig. 5).

Difficoltà nella visualizzazione dell’epitelio pigmentato retinico a causa della presenza di fluido e/o essudati.
Infine, abbiamo valutato la presenza di pseudodrusen reticolari (21, 22). Numerosi studi dimostrano un’associazione tra pseudodrusen e forme avanzate di AMD (CNV, atrofia geografica e atrofia della retina esterna) (12-17). Utilizzando una luce blu, Cohen e collaboratori avevano dimostrato una prevalenza di pseudodrusen del 24% nei pazienti con CNV naïve e una più frequente associazione con le RAP rispetto agli altri tipi di CNV (12). Zweifel e collaboratori, sempre utilizzando una luce blu, avevano riportato una prevalenza di pseudodrusen di 8,7% nei pazienti con vari stadi di AMD, ma la prevalenza diventava del 38,4% se valutata con SD-OCT (13). Una prevalenza ancora maggiore (62%) era stata rilevata da Schmitz-Valckenberg et al and the GAP Study Group utilizzando un oftalmoscopio a scansione laser confocale in pazienti con atrofia geografica secondaria ad AMD (16). Ueda-Arakawa e collaboratori avevano dimostrato che la prevalenza di pseudodrusen reticolari era maggiore nei pazienti con RAP (83.3%) o atrofia geografica (50%) rispetto alle altre forme di AMD (17) ed avevano attribuito la discrepanza nei valori di prevalenza delle pseudodrusen riportati alle diverse tecniche di imaging utilizzate per valutarle.
Nel nostro studio, tutti i segni valutati si sono dimostrati fortemente associati con la presenza di lesioni di tipo RAP, in particolare il leakage tardivo in ICGA, le pseudodrusen reticolari e l’edema cistoide. In un precedente studio, era stato riportato che l’edema cistoide era maggiormente evidente nelle RAP attive rispetto agli altri tipi di CNV (25). L’importanza di questi risultati risiede nell’elevata riproducibilità di queste determinazioni, con un agreement inter-osservatore pari a 1.
Il “furto vascolare” è stato il segno più difficile da valutare: questo è probabilmente dovuto al fatto che la sua determinazione richiede immagini FA ed ICGA dinamiche e di alta qualità; inoltre, riteniamo che la sua presenza dipenda dallo stadio di RAP, essendo meno evidente o addirittura non presente nello stadio 1. Il “furto vascolare”, così come il leakage tardivo in ICGA, possono essere spiegati dal fatto che le RAP sono delle lesioni neovascolari ad alto flusso, a differenza degli altri tipi di CNV; inoltre le RAP sono lesioni inizialmente intraretiniche e non c’è pertanto un mascheramento della fluorescenza da parte delle cellule dell’epitelio pigmentato retinico.
Questo studio ha diverse limitazioni. Una di queste è la dimensione limitata del campione: i risultati ottenuti dovrebbero essere estesi ad un campione più ampio all’interno di uno studio prospettico. Inoltre, l’attendibilità delle informazioni fornite dalle singole tecniche di imaging è fortemente dipendente dalla qualità delle immagini ottenute. Infine, la valutazione di alcuni segni può richiedere un training adeguato e un certo grado di esperienza dell’osservatore.
In conclusione, un approccio multi-imaging è di grande aiuto nella diagnosi differenziale tra i diversi tipi di CNV e ha importanti implicazioni prognostiche che possono influenzare i risultati terapeutici. Infatti, la valutazione di un singolo segno può rendere la diagnosi difficoltosa e inaffidabile. Questo è importante sia nella pratica clinica che nei trials clinici multicentrici: nel primo caso, infatti, riconoscere una lesione di tipo RAP può condurre ad un follow up più aggressivo con migliori risultati prognostici; nel secondo caso, invece, una classificazione corretta del tipo di lesione è obbligatoria quando si considerano i risultati e i possibili bias.
BIBLIOGRAFIA
- Hawkins BS, Bird A, Klein R, West SK. Epidemiology of age-related macular degeneration. Mol Vis 1999;5:26.
- Ting TD, Oh M, Cox TA, et al. Decreased visual acuity associated with cystoid macular edema in neovascular age-related macular degeneration. Arch Ophthalmol 2002;120:731-7.
- Bressler NM, Bressler SB, Fine SL. Age-related macular degeneration. Surv Ophthalmol 1988;32:375-413.
- Pauleikhoff D. Neovascular age-related macular degeneration: natural history and treatment outcomes. Retina 2005;25:1065-84.
- Macular Photocoagulation Study Group. Argon laser photocoagulation for neovascular maculopathy. Three-year results from randomized clinical trials. Arch Ophthalmol 1986;104:694-701.
- Gess AJ, Fung AE, Rodriguez JG. Imaging in neovascular age-related macular degeneration. Seminars in Ophthalmol 2011;26:225-33.
- Yannuzzi LA, Negrao S, Iida T, et al. Retinal angiomatous proliferation in age-related macular degeneration. Retina 2001;21:416-34.
- Viola F, Massacesi A, Orzalesi N, et al. Retinal angiomatous proliferation: natural history and progression of visual loss. Retina 2009;29:732-9.
- Hartnett ME, Weiter JJ, Staurenghi G, Elsner AE. Deep retinal vascular anomalous complexes in advanced advanced age-related macular degeneration. Ophthalmology 1996;103:2042-53.
- Polito A, Napolitano MC, Bandello F, Chiodini RG. The role of optical coherence tomography (OCT) in the diagnosis and management of retinal angiomatous proliferation (RAP) in patients with age-related macular degeneration. Ann Acad Med Singapore 2006;35:420-4.
- Querques G, Atmani K, Berboucha E, et al. Angiographic analysis of retinal-choroidal anastomosis by confocal scanning laser ophthalmoscopy technology and corresponding (eye-tracked) spectral-domain optical coherence tomography. Retina 2010;30:222-34.
- Cohen SY, Dubois L, Tadayoni R, et al. Prevalence of reticular pseudodrusen in age-related macular degeneration with newly diagnosed choroidal neovascularization. Br J Ophthalmol 2007;91:354-9.
- Zweifel SA, Imamura Y, Spaide TC, et al. Prevalence and significance of subretinal drusenoid deposits (reticular pseudodrusen) in age-related macular degeneration. Ophthalmology 2010;117:1775-81.
- Grunwald JE, Daniel E, Huang J, et al. for the CATT Research Group. Risk of geographic atrophy in the comparison of age-related macular degeneration treatment trials. Ophthalmology 2014;121:150-61.
- Finger RP, Wu Z, Luu CD, et al. Reticular pseudodrusen: a risk factor for geographic atrophy in fellow eyes of individuals with unilateral choroidal neovascularization. Opthalmology 2014;121:1252-6.
- Schmitz-Valckenberg S, Alten F, Steinberg JS, et al. for the geographic atrophy progression (GAP) study group. Reticular drusen associated with geographic atrophy in age-related macular degeneration. Invest Ophthalmol Vis Sci 2011;52:5009-15.
- Ueda-Arakawa N, Ooto S, Nakata I, et al. Prevalence and genomic association of reticular pseudodrusen in age-related macular degeneration. Am J Ophthalmol 2013;155:260-9.
- Fernandes LH, Freund KB, Yannuzzi LA, et al. The nature of focal areas of hyperfluorescence or hot spots imaged with ICGA. Retina 2002;22:557-68.
- Bottoni F, Romano M, Massacesi A, Bergamini F. Remodeling of the vascular channels in retinal angiomatous proliferations treated with intravitreal triamcinolone acetonide and photodynamic therapy. Graefes Arch Clin Exp Ophthalmol 2006;244:1528-33.
- Kuhn D, Meunier I, Soubrane G, Coscas G. Imaging of chorioretinal anastomoses in vascularized retinal pigment epithelium detachments. Arch Ophthalmol 1995;113:1392-8.
- Zweifel SA, Spaide RF, Curcio CA, et al. Reticular Pseudodrusen are subretinal drusenoid deposits. Ophthalmology 2010;117:303-12.
- Suzuki M, Sato T, Spaide RF. Pseudodrusen subtypes as delineated by multimodal imaging of the fundus. Am J Ophthalmol 2014;157:1005-12.
- Gross NE, Aizman A, Brucker A, et al. Nature and risk of neovascularization in the fellow eye of patients with unilateral retinal angiomatous proliferation. Retina 2005;25:713-8.
- Bottoni F, Massacesi A, Cigada M, et al. Treatment of retinal angiomatous proliferation in age-related macular degeneration: a series of 104 cases of retinal angiomatous proliferation. Arch Ophthalmol 2005;123:1644-50.
- Giani A, Luiselli C, Esmaili DD, et al. Spectral-domain optical coherence tomography as an indicator of fluorescein angiography leakage from choroidal neovascularization. Invest Ophthalmol Vis Sci 2011;52:5579-86.