INTRODUZIONE
Il glaucoma ad angolo aperto è una neurodegenerazione progressiva delle cellule ganglionari della retina (RGC, Retinal Ganglion Cells) e dei loro assoni caratterizzata da tipiche alterazioni del campo visivo e da un danno della testa del nervo ottico. Gli studi clinici hanno confermato l’importanza della IOP (Intraocular Pressure) nello sviluppo e nella progressione del glaucoma ad angolo aperto, anche se l’evidenza suggerisce l’esistenza di fattori oculari e sistemici, oltre alla IOP, che possono essere responsabili.
Lo scopo del nostro studio retrospettivo osservazionale è quello di descrivere le caratteristiche di un campione di popolazione, in trattamento presso il Centro glaucoma della Clinica Oculistica dell’Università di Torino per valutare la progressione del danno sulla base dei fattori di rischio individuali emersi.
MATERIALI E METODI
Questo studio è stato eseguito in conformità con gli standard etici fissati dalla Dichiarazione di Helsinki del 1964 e dalle sue successive modifiche.
In questo studio osservazionale retrospettivo, abbiamo incluso 190 pazienti (377 occhi) visitati almeno una volta negli ultimi 18 mesi (gennaio 2013 - giugno 2014) in cura presso il nostro centro.
Tutti i pazienti erano di razza caucasica, residenti in Italia, affetti da glaucoma primario ad angolo aperto (POAG), con danni confermati del campo visivo e danni glaucomatosi acquisiti alla testa del nervo ottico o allo strato delle fibre nervose.
I parametri di inclusione dello studio prevedevano:
- regolari esami di follow-up presso il nostro centro, con un minimo di due esami all’anno per almeno tre anni consecutivi;
- almeno un esame del campo visivo all’anno (cioè almeno quattro test perimetrici validi), eseguito utilizzando il programma SITA standard (Swedish Interactive Threshold Algoritm) 30-2 o 24-2 dell’Humphrey Field Analyzer (Carl Zeiss Meditec, Dublin, California, USA);
- almeno tre esami validi GDx-VCC (GDx nerve fiber analyzer, Carl Zeiss Meditec Inc., Dublin, CA, USA) durante il periodo di follow-up, con almeno un anno di distanza l’uno dall’altro.
I pazienti sono stati classificati come affetti da POAG quando mostravano un tipico campo visivo glaucomatoso e/o tipici danni alla testa del nervo ottico, angolo aperto alla gonioscopia, IOP > 21 mmHg senza trattamento e nessuna causa secondaria clinicamente apparente per il glaucoma.
I campi visivi sono stati valutati con l’Humphrey Field Analyzer. Un difetto del campo visivo di tipo glaucomatoso è stato definito come:
- tre punti adiacenti depressi di 5 dB, con uno dei punti depresso di almeno 10 dB;
- due punti adiacenti depressi di 10 dB;
- differenza di 10 dB sul meridiano orizzontale nasale di due punti adiacenti.
L’esame del campo visivo è stato considerato affidabile solo quando le risposte falso-negative e falso-positive erano inferiori al 30% e le perdite di fissazione erano meno del 20% all’HFA.
La anomalia del nervo ottico si basava sulla presenza di notch sulla rima neuroretinica oppure perdita diffusa o generalizzata del tessuto della rima neuroretinica oppure asimmetria del rapporto cup/disc sul diametro verticale (non spiegata dalle differenze della grandezza della papilla) oppure emorragia peri-papillare.
I dati GDx nel periodo di follow up considerato erano disponibili solo per 56 pazienti (112 occhi). Abbiamo deciso di utilizzare il NFI (Neural Fiber Index).
I parametri di esclusione dello studio prevedevano:
- mancanza di dati e di un adeguato follow-up;
- insoddisfacente compenso della IOP durante il follow-up tale che i pazienti hanno necessitato di un intervento chirurgico o di impiantare una valvola o uno stent;
- insorgenza di altre patologie oculari durante il periodo di follow-up;
- diagnosi di distrofia maculare o di maculopatia nei pazienti con i dati GDx;
- pazienti di età inferiore a 18 anni;
- donne in gravidanza o in allattamento;
- incapacità di capire come eseguire e/o completare i test.
Sono stati esclusi i pazienti con cataratta in evoluzione, tale da generare un peggioramento dell’acuità visiva superiore a 3/10 in tutto il periodo di follow-up.
Al fine di analizzare il campione, abbiamo utilizzato un questionario anamnestico creato apposta per il nostro studio, la cui compilazione è stata eseguita in presenza di personale paramedico.
Per la registrazione dei dati epidemiologici e clinici abbiamo utilizzato il programma “Glaucoma Management System Database” (Daniela Paoli, Italia).
Questo programma di elaborazione dati è costituito da un database di semplice comprensione e offre la possibilità di memorizzare i dati dei pazienti come supporto alla diagnosi e alla terapia; è stato creato per contenere l’intera storia clinica dei pazienti e permette l’accesso ai dati remoti e recenti in tempo reale.
Per l’elaborazione dei dati è stato necessario utilizzare una ulteriore programmazione Access ed Excel (Microsoft Corporation, Redmond, WA, USA).
La progressione glaucomatosa è stata definita in base alla variabile dipendente MD (Mean Defect) del campo visivo utilizzando il Metodo del Generalized Linear Model (GLM). Abbiamo deciso di analizzare anche la variabile dipendente NFI (Neural Fiber Index) del GDx. Sono state prese in considerazione le seguenti variabili:
- età;
- sesso;
- pressione intraoculare al follow-up (misurata in mmHg con il tonometro ad applanazione di Goldmann);
- pachimetria (spessore centrale della cornea, CCT misurato in micrometri con pachimetro ad ultrasuoni);
- miopia > 4 diottrie;
- ipotiroidismo;
- diabete mellito;
- ipercolesterolemia;
- ipertensione arteriosa;
- uso di corticosteroidi topici e/o sistemici per un periodo di tempo prolungato (più di 15 giorni negli ultimi 2 mesi prima del follow-up considerato);
- ipoacusia;
- emicrania;
- vasospasmo;
- cardiopatia ischemica;
- fumo;
- asma;
- depressione.
Dal punto di vista statistico, il GLM è una generalizzazione della ordinaria regressione dei minimi quadrati. GLM indica tutta una serie di tecniche per l’analisi statistica dei dati con l’obiettivo di predire il comportamento di alcuni elementi, mentre altre variabili si stanno modificando. Lo scopo è di prendere come modello un fenomeno per ricavare una legge che abbia validità generale e possa dare indicazioni sul fenomeno stesso oltre ad essere facilmente utilizzabile. Il modello lineare generalizzato comprende diversi modelli statistici: ANOVA, ANCOVA, MANOVA, MANCOVA, regressione lineare ordinaria, t test e F test. I GLMs permettono trasformazioni lineari o combinazioni lineari di variabili dipendenti multiple. Questa estensione offre importanti vantaggi:
- possiamo impiegare test di significatività anche quando le risposte alle variabili dipendenti multiple sono correlate;
- i test su combinazioni lineari possono farci intuire se le variabili dipendenti sono o no in relazione con le variabili indipendenti;
- la capacità di analizzare gli effetti di misure ripetute: combinazioni lineari delle risposte che riflettono effetti di misure ripetute (ad esempio misure delle stesse grandezze in diverse condizioni) possono essere costruite e testate con il GLM.
I GLM sono stati ideati da John Nelder e Robert Wedderburn per unificare i vari altri modelli statistici, tra cui la regressione lineare, la regressione logistica e la regressione di Poisson. Hanno proposto un metodo dei minimi quadrati pesato in itinere per una stima più verosimile dei parametri del modello.
L’analisi è stata eseguita utilizzando il SAS 9.1. L’effetto delle varie caratteristiche individuali sul valore della MD a diversi tempi di osservazione (t0, t1, t2, t3) è stato stimato utilizzando un modello lineare generalizzato per misure ripetute. Il termine “misure ripetute” usato in questo lavoro si riferisce a più risposte prese in sequenza nella stessa unità sperimentale, ovvero nello stesso paziente. La caratteristica delle misure ripetute che richiede particolare attenzione nell’analisi dei dati è il modello di correlazione tra le risposte dello stesso paziente nel corso del tempo, come ogni tipico esempio di un’analisi fattoriale.
Il modello utilizzato è Mean Deviation = età, sesso, IOP, pachimetria, miopia > 4 diottrie, ipotiroidismo, diabete mellito, ipercolesterolemia, ipertensione arteriosa, corticosteroidi, ipoacusia, emicrania, vasospasmo, cardiopatia ischemica, fumo, asma, depressione in cui la MD è la variabile dipendente ed età, sesso, IOP… sono le variabili indipendenti.
Abbiamo deciso di eseguire anche un modello NFI = età, sesso, IOP, pachimetria, miopia > 4 diottrie, ipotiroidismo, diabete mellito, ipercolesterolemia, ipertensione arteriosa, corticosteroidi, ipoacusia, emicrania, vasospasmo, cardiopatia ischemica, fumo, asma, depressione per i 56 pazienti che avevano dati al GDx durante tutto il periodo di follow-up.
L’effetto delle variabili indipendenti è stato inizialmente testato in un’analisi statistica univariata; solo le variabili che hanno mostrato un effetto significativo all’analisi univariata sono state inserite nel modello GLM finale.
RISULTATI
Sono stati inclusi 190 pazienti caucasici (377 occhi) affetti da POAG, 76 maschi (40%) e 114 femmine (60%).
L’età media era pari a 61.49 ± 9.58 anni (33.5-87.9). L’età media fra i maschi era di 60.1 ± 8.7 anni e l’età media tra le femmine era di 62.11 ± 10.1 anni.
Il follow-up medio nel nostro studio è stato di 79 mesi, pari a 6.58 anni.
Il quesito era quali sono i fattori determinanti, scelti tra quelli più significativi riportati in letteratura, responsabili della progressione del danno nei pazienti affetti da glaucoma cronico ad angolo aperto.
Nel campione esaminato, i fattori che hanno raggiunto la significatività statistica, determinando un peggioramento della variabile MD, sono: età (p<0.0001), IOP al follow-up (p < 0.0001), sesso femminile (p<0.0001), ipertensione (p< 0.0001) e familiarità (p = 0.0006)(fig. 1).
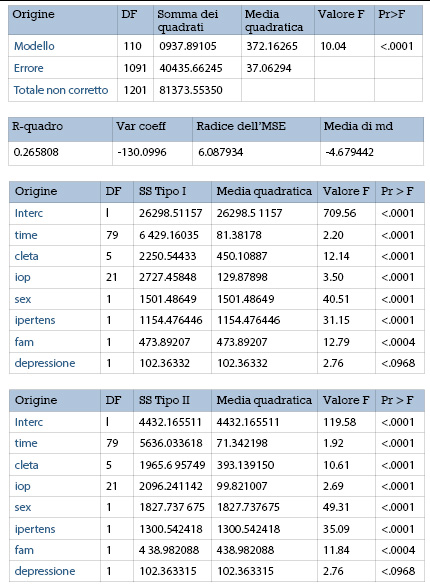
Nel campione esaminato, i fattori che hanno raggiunto la significatività statistica, determinando un peggioramento della variabile NFI, sono solo la IOP al follow-up (p = 0.0159) e la depressione (p = 0.0104) (fig. 2).
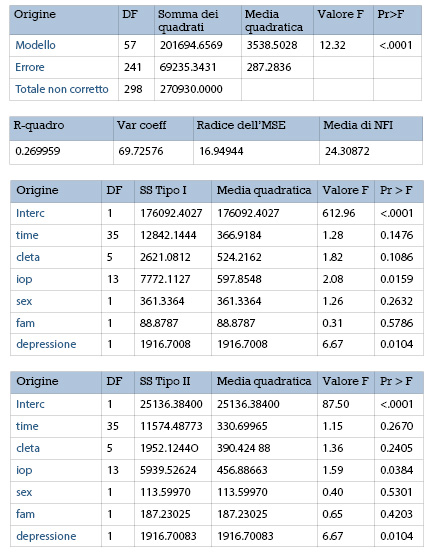
Gli altri parametri presi in considerazione non hanno raggiunto la significatività statistica.
Inoltre, abbiamo stimato che, in media, per ogni mmHg di aumento della IOP, si verificava un peggioramento della variabile MD di -8.82 dB, equivalente a -1.34 dB all’anno (fig. 3).

DISCUSSIONE
L’eziologia del POAG è incerta ancora oggi: per questo è importante eseguire nuovi studi epidemiologici.
In letteratura diversi fattori sono stati indicati come possibili fattori di rischio (fig. 4).
Tuttavia se consideriamo gli studi con una significatività statistica reale i fattori di rischio che si evidenziano sono molto pochi.
Il Canadian Glaucoma Study ha affermato che i fattori che portano ad un peggioramento della variabile MD nel corso del tempo sono:
- età;
- sesso femminile;
- alto livello di anticorpi anti-cardiolipina;
- IOP.
Valutazioni successive dello stesso gruppo hanno sottolineato l’importanza particolare dell’età e del livello degli anticorpi anticardiolipina.
In una analisi recente, Weinreb e Medeiros hanno riassunto i pochi parametri significativi: età avanzata, storia familiare di glaucoma, razza nera, uso di corticosteroidi topici o sistemici, pressione intraoculare elevata.
In letteratura è evidente che il principale fattore di rischio è rappresentato dalla IOP, già dall’anno 1622 quando Richard Banister diede la prima reale descrizione del glaucoma in lingua inglese.
L’analisi statistica che abbiamo eseguito ha indicato che il principale fattore di rischio per l’insorgenza e la progressione del danno è la IOP: in particolare ogni mmHg di aumento medio della IOP corrisponde a un peggioramento medio della variabile MD di - 8,82 dB, pari a - 1,34 dB l’anno.
Lo studio Early Manifest Glaucoma Trial, EMGT ha evidenziato che ad ogni mmHg di aumento della IOP corrisponde una possibile crescita del 10% del rischio di progressione. Una riduzione della IOP del 25% ottenuta mediante un trattamento standardizzato (laser + betaxololo) ha permesso un rallentamento della progressione della malattia dal 62% al 45% dopo 6 anni di follow-up. In conclusione l’EMGT ha indicato la IOP elevata e la pseudoesfoliazione come fattori di rischio significativi della progressione.
Il Canadian Glaucoma Study ha confermato come la IOP media al follow-up (prima che ci fosse una progressione) era direttamente proporzionale alla progressione stessa. Ogni mmHg di aumento della IOP provocava un aumento del rischio di circa il 19%: la progressione sembrava più pronunciata nei pazienti con manifestazioni vasospastiche.
I picchi della pressione e le fluttuazioni della IOP giocano un ruolo decisivo: l’Advanced Glaucoma Intervention Study (AGIS) ha dimostrato come fattore di rischio della progressione del danno la variabilità della IOP tra un esame e l’altro.
Il nostro studio indica anche che, una volta espressa la diagnosi di POAG, all’aumentare dell’età si ha una maggiore progressione del danno.
Considerando la prevalenza, il rischio che il glaucoma aumenti con l’età è stato notato in quasi tutti gli studi sulla popolazione. Alcuni autori hanno sottolineato come l’aumento reale della prevalenza diventi significativo dopo l’età di 60 anni (studi di Ferndale, Bedford, Dalby, Blue Mountains, Casteldaccia) o addirittura di 70 anni (Framingham, Baltimora, Ponza).
Chaunan ha identificato l’età come il principale fattore predittivo indipendente: nel suo studio i soggetti con età maggiore di 60 anni presentavano una percentuale dei difetti perimetrali di tipo glaucomatoso sette volte maggiore rispetto a quella rilevata fra gli individui sotto i 40 anni.
Coleman e Miglior hanno recentemente proposto un’analisi che ha suddiviso i pazienti in tre gruppi: progressione da soggetto normale a glaucomatoso; progressione da soggetto affetto da ipertensione oculare a glacomatoso; progressione del danno nel soggetto affetto. In tutti i gruppi l’età è risultata essere un fattore di rischio statisticamente significativo.
Lo stesso risultato è emerso in altri studi.
Riguardo al sesso, se osserviamo un campione degli studi possiamo dedurre che in alcuni di essi non c’è alcuna differenza statisticamente significativa, in altri studi i maschi sembrano essere più colpiti e in altri ancora lo sono le femmine.
Il Canadian Glaucoma Study ha osservato un fattore di rischio nel sesso femminile (HR 1.94 i.c. 1.09-3.46, p value .02) ma ha osservato un fattore di rischio ancora più elevato in presenza elevata di anticorpi anticardiolipina (ACA) (HR 3.86 i.c. 1.60-9.31, p value .003).
Il nostro studio conferma che il genere femminile può essere associato ad una progressione maggiore del danno. Si può supporre che i cambiamenti ormonali tipici delle donne e legati all’età possano essere responsabili di questi dati.
Dobbiamo anche ricordare che il rischio cardiovascolare può essere più elevato nelle donne.
Il carattere di familiarità del glaucoma è noto da decenni. In alcuni studi, tra cui la Baltimore Survey, il 50% dei pazienti affetti aveva una familiarità positiva e questo suggerisce che il difetto genetico possa essere importante per lo sviluppo della patologia.
Lo studio condotto in Olanda da Wolfs nel 1998 ha riscontrato nei parenti di primo grado di un soggetto affetto da POAG un rischio pari al 22% di sviluppare la patologia, rispetto al 2.3% della popolazione generale analizzata.
Altri studi indicano gradi diversi di aumento del rischio di sviluppare POAG nei parenti di primo grado, che sono da 3 a 9 volte superiori rispetto a quelli della popolazione normale.
La correlazione tra ipertensione arteriosa e glaucoma è meno chiara. Alcuni studi confermano questa associazione, altri no.
Nel 2011 Zheng ha proposto un’analisi dei lavori clinici per verificare la correlazione tra pressione sanguigna e glaucoma, e ha concluso che, anche se l’associazione tra pressione arteriosa elevata e IOP è chiara, quella tra glaucoma e pressione arteriosa sembra essere più complessa da accertare.
Tra le ipotesi che sono state formulate, una ipotizza che entrambe le patologie (IOP e aumento della pressione arteriosa) possono dipendere da un fattore comune: l’aumento dell’attività del sistema nervoso simpatico correlata all’età avanzata.
Inoltre, un aumento della pressione arteriosa, aumentando il livello della pressione sulle arterie ciliari, potrebbe aumentare l’ultrafiltrazione e - di conseguenza - la produzione di umore acqueo; o potrebbe anche determinare un aumento della pressione venosa con riduzione della clearance dell’umore acqueo stesso.
Per quanto riguarda la relazione tra pressione arteriosa e glaucoma, Zheng sottolinea ancora una volta come l’accordo tra i risultati di tutti gli studi non sia unanime: 11 studi riportano un’associazione statisticamente significativa tra ipertensione e glaucoma (tra questi il Blue Mountains e il Rotterdam Eye Study), mentre altri 10 hanno dimostrato delle correlazioni tra glaucoma e ipotensione arteriosa.
Il Baltimore Eye Survey ha evidenziato come l’associazione tra pressione arteriosa e POAG fosse età-dipendente: in particolare, l’ipertensione sistemica sembrerebbe proteggere dal glaucoma i pazienti giovani, mentre aumenterebbe il rischio nei pazienti più anziani. A questo proposito gli autori ipotizzano che il nervo ottico possa trarre beneficio da una pressione di perfusione elevata (e quindi dall’alta pressione arteriosa sistemica) quando i vasi sanguigni sono normali (cioè nell’età del giovane-adulto), mentre sottolineano come nella popolazione anziana le modifiche aterosclerotiche della dinamica dei vasi, compromettono gli scambi a livello capillare, e perciò l’ipertensione sistemica non ha più un effetto protettivo. Analogo concetto veniva dimostrato nel Los Angeles Latino Eye Study ove la relazione tra prevalenza di glaucoma e pressione arteriosa diastolica veniva rappresentata da un grafico a “U”: i pazienti sulle estremità del risultato dello spettro avevano un aumento del rischio di sviluppare questa patologia. Questo apparente paradosso veniva appunto spiegato con due considerazioni: la prima è che i pazienti che progredivano erano caratterizzati da una bassa pressione di perfusione a livello della testa del nervo ottico; la seconda è che l’ipertensione cronica associata all’aterosclerosi determinava un aumento della resistenza dei vasi e una compromissione dell’autoregolazione vascolare, riducendo gli scambi nutritivi a livello del letto capillare della testa del nervo ottico causando progressione del danno.
Inoltre, considerando solo il rischio cardiovascolare, è particolarmente interessante il recente studio di Lee (legato al Blue Mountains Eye Study) in cui in tutti i pazienti con diagnosi di glaucoma emerge un aumento della mortalità cardiovascolare. Tale mortalità risulta più elevata nei pazienti in trattamento con timololo.
Con pressione di perfusione normalmente si intende la differenza tra pressione arteriosa e venosa. Tuttavia, a livello oculare, la pressione venosa è molto simile alla IOP e quindi la pressione di perfusione oculare (OPP) può essere calcolata come differenza tra la pressione arteriosa media (MAP) a livello dell’arteria oftalmica e la IOP (OPP = MAP oftalmica -IOP). La MAP oftalmica di solito non si misura nella pratica clinica: si utilizza la pressione arteriosa misurata a livello dell’arteria brachiale (MAP brachiale) che risulta essere una buona stima della precedente in assenza di una patologia vascolare. L’equazione può essere riformulata come: OPP = 2/3 MAP brachiale -IOP. Questa equazione mostra come l’OPP possa diminuire sia per la diminuzione della pressione arteriosa media che per l’aumento della IOP. È una considerazione che potrebbe spiegare il motivo per cui alcuni pazienti glaucomatosi continuano a sviluppare il deficit del campo visivo nonostante una terapia ipotonizzante efficace: una bassa pressione arteriosa sistemica potrebbe contrastare l’aumento dell’OPP promosso dalla riduzione della IOP.
Tuttavia ricordiamo che si devono adottare alcune precauzioni se si utilizza l’equazione sopra menzionata per determinare la OPP: innanzitutto, come sottolineato in precedenza, la MAP brachiale è una misura sostitutiva adeguata della MAP oftalmica in assenza di patologie vascolari, come ad esempio l’aterosclerosi, spesso correlata all’ipertensione cronica. In questo caso, la pressione sistemica potrebbe non essere una misura sostitutiva adeguata della pressione a livello locale. Inoltre, l’aumento della IOP può determinare una compressione meccanica a livello degli assoni, che potrebbe non essere reversibile dopo il calo della pressione sistemica, provocando una ipoperfusione locale.
Una piccola riduzione della OPP non implica sempre un deficit della vascolarizzazione perché la retina cerca di mantenere costante la circolazione in risposta alle modifiche ambientali.
Quindi il flusso sanguigno a livello oculare non è determinato solo dalla OPP, ma anche dalle resistenze vascolari secondo la legge di Hagen-Poiseuille: Q= (πR4ΔP)/8ηL. Q è il flusso sanguigno, R è il raggio della vena, Δp è la perdita di pressione nella vena, η è la viscosità dinamica, L è la lunghezza del vaso.
L’autoregolazione del flusso sanguigno retinico può essere una risposta alle modifiche della OPP. Un vasodilatazione compensatoria è stata dimostrata quando aumenta la IOP nei pazienti glaucomatosi; inoltre l’entità della modifica del calibro è associata al livello dell’aumento della IOP. La risposta vasale alle modifiche della IOP è meno efficace nei pazienti affetti da glaucoma rispetto ai pazienti sani (in cui l’autoregolazione a livello della testa del nervo ottico è efficace per valori di IOP inferiori a 27-30 mmHg). Il flusso sanguigno rimane costante per riduzioni della OPP pari al 40-50% rispetto al valore iniziale e per aumenti inferiori al 30%: alcuni studi hanno anche dimostrato che il flusso rimane costante per valori di pressione di perfusione oculare pari al 34-60% rispetto ai valori iniziali.
Per quanto riguarda i meccanismi alla base della autoregolazione a livello oculare, il ruolo svolto dai fattori ormonali (adrenalina e noradrenalina) sembra essere meno importante rispetto a quello svolto dalle stesse molecole a livello sistemico: a livello della retina e della testa del nervo ottico, infatti, non è presente l’innervazione autonomica.
Tuttavia la circolazione coroideale riceve un importante input autonomico e i recettori adrenergici alfa e beta sono presenti a livello dei vasi sanguigni oculari.
Di conseguenza, alte concentrazioni di catecolamine a livello sistemico (come accade nell’ipertensione) o a livello locale (se si utilizzano beta bloccanti antiglaucomatosi e farmaci alfa agonisti) possono causare ripercussioni sul flusso sanguigno a livello retinico.
È importante anche la regolazione miogenica mediata dai meccanorecettori (canali ionici permeabili al calcio) localizzata a livello dell’endotelio vascolare che risponde alle variazioni di pressione rilasciando mediatori vasoattivi (i due principali mediatori dell’autoregolazione del flusso sono l’ossido nitrico, con effetto vasodilatatore, e l’endotelina-1, con effetto vasocostrittore).
Dobbiamo infine parlare della regolazione delle vie metaboliche mediata dalle alterazioni di O2 e di CO2: a questo proposito, ipossia e ipercapnia determinano una vasodilatazione a livello della retina, mentre l’aumento della PaO2 provoca la vasodilatazione.
Dobbiamo poi considerare che alcuni studi miravano a confermare una possibile associazione tra le alterazioni vascolari e il glaucoma.
Leske ha sottolineato come i diversi studi clinici hanno dimostrato una forte correlazione tra una bassa pressione di perfusione e la progressione del danno: anche in questo caso un fattore comune potrebbe essere l’alterazione dell’autoregolazione vascolare.
Secondo il Blue Mountains Study, una bassa pressione di perfusione aumenta la velocità di progressione del danno; anche un improvviso calo della pressione durante la notte, abbassando la pressione di perfusione, è un fattore di rischio per la progressione.
L’analisi dei lavori clinici eseguita da Werne nel 2008 ha concluso che il calo non fisiologico della PAOS durante la notte e, in generale, gli sbalzi di pressione di perfusione sono importanti fattori di rischio correlati allo sviluppo e alla progressione del glaucoma, anche se non c’è un accordo unanime in letteratura.
Il recente Beijing Eye Study, al contrario degli studi occidentali, non ha rilevato una associazione statisticamente significativa tra POAG e pressione di perfusione oculare; è importante considerare che la maggior parte dei pazienti dello studio non erano stati trattati e la loro pressione intraoculare era inferiore a 22 mmHg.
Joe e collaboratori hanno incluso invece nello studio 54 occhi di 54 pazienti con diagnosi di glaucoma a pressione normale, controllando la PAOS durante la notte mentre dormivano nella loro posizione abituale. I pazienti sono stati quindi classificati in tre gruppi: “non dipper”, “dipper”, “over-dipper” secondo il grado di diminuzione della pressione arteriosa notturna rispetto a quella diurna. Gli autori hanno creato dei modelli di regressione per aggiustare i dati in base all’età, alla pachimetria, al valore della IOP prima dello studio e ai parametri pressori. Al fine di valutare l’insorgenza e la progressione del danno, hanno usato gli indici MD e PSD dell’Humphrey visual field, l’analisi TSNIT e l’NFI del GDx-VCC. Questo studio ha dimostrato come la riduzione notturna della pressione arteriosa era direttamente collegata alla progressione del danno.
Il gruppo di Ali El Afrit ha preso in esame pazienti con diagnosi di glaucoma a pressione normale e POAG e ha concluso che, nella maggior parte dei pazienti, erano presenti uno o più fattori di rischio vascolare.
Gugleta ha sottolineato poi l’importanza dei fattori di rischio vascolari e dello stress ossidativo, concludendo che si deve eseguire una attenta analisi del profilo di rischio vascolare in ogni paziente affetto da glaucoma.
Tornando al nostro studio, molti fattori di rischio presunti non raggiungono la significatività statistica. Possono sempre ricoprire un ruolo, anche se, considerati da soli, non sono determinanti. Per esempio, l’infarto ischemico o il diabete possono essere collegati all’ipertensione o a modifiche vascolari.
Tra i fattori non significativi del nostro studio è particolarmente interessante il ruolo dello pachimetria (spessore centrale della cornea).
Sulla base dei risultati dell’OHTS è stata data molta importanza a questo parametro e sono stati proposti algoritmi universali di conversione tonometrica; in realtà il peso di questo fattore di rischio è sì importante, ma ancora da capire con esattezza. Sono necessari studi su molti campioni per giungere a conclusioni definitive. In particolare è necessario analizzare tre aspetti: peso reale della pachimetria sulla pressione intraoculare; legame tra pachimetria e altri fattori (è presente solo un fattore meccanico nell’applanazione con il tonometro di Goldmann?); legame tra la terapia ipotonizzante e la pachimetria.
Ci sono diversi studi che hanno cercato di confermare o meno l’associazione tra ipotiroidismo e POAG: hanno ottenuto risultati spesso contrastanti.
È già chiaro il rapporto tra ipertiroidismo, specialmente nella malattia di Graves-Basedow, e la IOP.
Alcuni studi sulla popolazione hanno studiato invece la possibile associazione tra POAG e ipotiroidismo, iniziando dal Blue Mountain Eye Study, che includeva 324 pazienti (8.9% della popolazione considerata) con problemi di tiroide, di cui 147 (il 4% della popolazione analizzata) erano in terapia con tiroxina. La prevalenza di POAG tra i pazienti con problemi alla tiroide è stata del 4.6% rispetto al 2.8% della restante popolazione. Aggiustando i dati per i fattori confondenti, il risultato non sembra essere statisticamente significativo, anche se si è evidenziato un rischio maggiore di sviluppare POAG nei pazienti in terapia con levotiroxina rispetto ai pazienti che precedentemente non mostravano patologie della tiroide.
Questi risultati, come sottolineato da Cross, non sono del tutto chiari. Il recente lavoro di Haefliger conclude che non si hanno evidenze sufficienti per affermare una relazione tra ipotiroidismo e glaucoma.
Considerando il GDx GLM che abbiamo deciso di creare, la IOP rimane l’unico fattore di rischio reale che ha ottenuto una significatività statistica. Il dato della depressione può essere interessante, ma ha alcuni limiti anche perché dovrebbe essere rivalutato per ogni paziente. Riteniamo che durante il questionario anamnestico sotto la voce “depressione” il paziente possa aver incluso diverse patologie.
Di sicuro possiamo affermare che:
- il glaucoma sembra essere legato a depressione, ansia e disturbi del sonno secondo diversi studi;
- non è chiaro il ruolo sulla IOP delle terapie sistemiche per queste patologie;
- vi è una forte evidenza che il glaucoma sia legato a patologie neurologiche, come il morbo di Alzheimer, il che può avere anche un rapporto patogenetico con la depressione degli anziani.
Il POAG presenta analogie importanti con altre malattie neurodegenerative: è stato dimostrato che i meccanismi di morte cellulare delle RGC e del nervo ottico sono simili a quelli del morbo di Alzheimer. In particolare i depositi di b-amiloide, caratteristici del morbo di Alzheimer, sono stati recentemente implicati nella patogenesi del glaucoma. L’amiloide β b42 non è solubile e si può depositare causando l’apoptosi. L’evidenza suggerisce che i pazienti affetti dal morbo di Alzheimer presentano una maggiore incidenza e prevalenza di glaucoma, così come i pazienti affetti da glaucoma sono caratterizzati da una maggiore incidenza e prevalenza del morbo di Alzheimer.
Alcuni studi hanno anche dimostrato che il morbo di Alzheimer provoca anomalie della retina: riduzione dello strato delle fibre nervose, costrizione venosa e riduzione del flusso sanguigno.
A conclusione di questa discussione vorremmo sottolineare la relazione tra la struttura (nervo ottico e fibre) e la funzione (campo visivo). Prima di tutto dobbiamo affermare che è molto più difficile parlare di progressione utilizzando solo un modello strutturale. Questo perché il rapporto tra struttura e funzione non sempre è chiaro né immediato.
È vero che, di solito, un assottigliamento delle fibre precede in qualche modo un danno funzionale, ma non è una regola generale.
In alcuni pazienti si osserva un peggioramento dei parametri strutturali, senza modifiche funzionali (il che ha un peso sulle decisioni cliniche). In altri pazienti possiamo notare dei cambiamenti funzionali senza importanti modifiche strutturali.
L’American Academy of Ophthalmology ha sottolineato recentemente come nessun OCT (al momento il dispositivo principale utilizzato per analizzare la struttura) presente sul mercato degli Stati Uniti abbia un’indicazione ‘stand-alone’ per la diagnosi di glaucoma.
È sicuramente interessante notare come la IOP rimanga l’unico parametro con una forte significatività statistica correlato al deterioramento strutturale secondo le valutazioni al GDx (NFI index) in un follow-up di 6.58 anni.
Nella pratica clinica è bene affidarsi a più strumenti che valutano la struttura (HRT, GDx e soprattutto OCT) per avere un’idea chiara della presenza o meno di una progressione del danno.
Il nostro studio ha numerosi limiti ed in particolare risulterebbe utile:
- ampliare il campione di popolazione;
- migliorare l’analisi strutturale, in particolare coinvolgendo un ampio campione di popolazione e con una
- valutazione all’OCT;
- migliorare i dati provenienti dal questionario anamnestico, rivalutando alcune patologie (come ad esempio la depressione);
- inserire nelle nostre analisi il tempo per giungere alla progressione (suddividendo il campione in “fast progressors-pazienti a progressione rapida” e “slow progressors-pazienti a progressione lenta”) considerando le differenze tra i due gruppi;
- considerare la terapia ipotonizzante di ogni paziente. È da sottolineare che comunque per i pazienti inseriti abbiamo seguito le linee guida EGS per raggiungere la IOP target e un buon compenso tonometrico.
CONCLUSIONE
I risultati di questo studio confermano e rafforzano i dati degli studi più recenti:
- la IOP rimane il principale fattore di rischio per valutare il glaucoma e la sua progressione;
- l’età e la familiarità sono importanti fattori di rischio, come sottolineato negli ultimi decenni;
- il sesso femminile può essere un rilevante fattore di rischio, come è emerso solo negli ultimi anni. Si tratta di una importante conferma dei risultati più recenti riportati in letteratura;
- l’ipertensione arteriosa può essere un significativo fattore di rischio, come ampiamente spiegato nella discussione.
Questo studio sottolinea come ad oggi sia obbligatorio verificare attentamente la anamnesi dei nostri pazienti glaucomatosi: è certamente utile una valutazione medica generale. Solo in questo modo è possibile eseguire un follow-up personalizzato con una tempistica appropriata.
Il glaucoma è ancora oggi un “mistero” ma, proprio per questo, un argomento stimolante per la ricerca scientifica: solo in un contesto di ricerca clinica potremo chiarirlo e arrivare a sconfiggere la prima causa di cecità irreversibile del mondo.
FACCIAMO IL PUNTO |
Fattori di rischio e glaucoma
|
Per informazioni riguardo alla bibliografia, contattare direttamente l’autore di riferimento