Definizione ed epidemiologia della cheratite neurotrofica
La cheratite neurotrofica è una malattia degenerativa della cornea, caratterizzata da riduzione o assenza di sensibilità corneale,associata alla formazione di difetti epiteliali con scarsa tendenza alla guarigione che possono evolvere in ulcera corneale, necrosi asettica e perforazione corneale. (1, 2) È stato dimostrato che la cheratite neurotrofica è causata dalla compromissione dell’innervazione sensoriale corneale fornita dal nervo trigemino. Infatti, l’innervazione trigeminale corneale non solo veicola la sensibilità corneale,ma fornisce anche i fattori trofici e i neuromediatori che svolgono un ruolo fondamentale nel mantenimento dell’integrità corneale, stimolando il rinnovamento, la guarigione e la funzionalità dell’epitelio corneale. (2) Di conseguenza tutte le condizioni che provocano un danno all’innervazione trigeminale corneale, possono condurre allo sviluppo della cheratite neurotrofica.
La cheratite neurotrofica è considerata una malattia rara, ed è classificata come malattia orfana (ORPHA137596) con una prevalenza stimata tra 1,6 e 4,2 / 10.000. (3) Di conseguenza, la cheratite neurotrofica viene riscontrata raramente nella pratica clinica ed è difficile da riconoscere, diagnosticare e da trattare. È comunque fondamentale saperlariconoscere, poiché la diagnosi precoce e il trattamento immediato sono fondamentalinella gestione di questa patologia, consentendo di mettere in atto tutte le misure terapeutiche disponibili atte a prevenire la progressione verso l’ulcera, la necrosi stromale e la perforazione corneale. Attualmente, il trattamento della cheratite neurotrofica è mirato a stimolare la guarigione dei difetti epiteliali e di prevenire la progressione verso danni corneali più severi, come l’ulcera e la perforazione, che potenzialmente possono portare alla perdita dell’occhio. Negli ultimi anni si è intensificato l’interesse per lo sviluppo di nuovi trattamenti specifici per la cheratite neurotrofica, in grado di stimolare la rigenerazione e il recupero dei nervi corneali e di migliorare la sensibilità corneale. (1)
Cause di cheratite neurotrofica
Tutte le patologie locali e sistemiche che causano un danno anatomico o funzionale a qualsiasi livellodell’innervazione trigeminale corneale, possono provocare cambiamenti morfologici e metabolici dei tessuti corneali e possono condurre allo sviluppo della cheratite neurotrofica. (3, 4) (Tab. 1) Infatti la riduzione del supporto trofico fornito dai nervi corneali induce una diminuzione del rinnovamento epiteliale corneale e della sua capacità di guarigione, associata ad una riduzione dei riflessi trigeminali con conseguente riduzione della funzione lacrimale e della frequenza di ammiccamento. (4)
| Malattie congenite | Sindrome di Riley-Day |
| Sindrome di Mobius | |
| Disautonomia familiare | |
| Sindrome di Goldenhar-Gorlin | |
| Ipoestesia corneale familiare | |
| Insensibilità congenita al dolore con anidrosi | |
| Malattie sistemiche | Diabete |
| Sclerosi multipla | |
| Lebbra | |
| Patologie del Sistema nervoso centrale | Neurochirurgia |
| Neoplasie | |
| Aneurismi | |
| Ischemia | |
| Patologie dell’orbita | Chirurgia |
| Traumatico | |
| Neoplasie | |
| Malattie oculari | Cheratite da Herpes simplex |
| Cheratite da Herpes zoster | |
| Ustioni | |
| Causticazioni | |
| Chirurgia | |
| Distrofie corneali | |
| Uso cronico di lenti a contatto | |
| Uso cronico di terapie topiche |
La causa più frequente di cheratite neurotroficaè la cheratite virale erpetica recidivante. Dopo l’infezione primaria, il virus herpes simplextipo 1 (HSV-1) e il virus varicella-zoster (VZV) stabiliscono un’infezione latente nei gangli trigeminali usando il trasporto assonale retrogrado. In caso di riattivazione, il virus raggiunge le cellule epiteliali corneali muovendosi in senso anterogrado attraverso fibre nervose trigeminali sensoriali e provoca lesioni nel tessuto innervato associate al danno dei nervi sensoriali e alla perdita della sensibilità corneale. Una volta guarita l’infezione, l’innervazione corneale mostra una rigenerazione, anche se incompleta, e, ad ogni recidiva della cheratite erpeticala perdita dei nervi sensorialiprogredisce, e può portare allosviluppo della cheratite neurotrofica nel 4-12% dei pazienti. (3, 5-8)
Il danno dei nervi sensoriali corneali può derivare da numerose altre cause locali, tra cui le procedure chirurgiche che coinvolgono le fibre trigeminali, come la chirurgia refrattiva, il trapianto di cornea e le incisioni corneali. (4, 9) Anche l’uso cronico di farmaci topici ocularie l’uso cronico di lenti a contatto possono causare danni ai nervi corneali e conseguente ipo/anestesia corneale. (10) Ustioni e causticazioni della superficie oculare possono danneggiare direttamente i nervi corneali e causare alterazioni della sensibilità corneale. (4) Inoltre, è stata descritta una diminuzione della sensibilità corneale anche in pazienti con deficit di cellule staminali limbari. (11) Tumori oculari o orbitali, traumi o interventi chirurgici dell’orbita possono danneggiare il ramo oftalmico del nervo trigemino e determinare l’insorgenza di cheratite neurotrofica. Altre cause di lesioni dirette del nervo trigemino che possono causare la cheratite neurotrofica sono i trattamenti chirurgici del trigemino, oppure il nervo trigemino può subire una compressione da lesioni intracraniche occupanti spazio come il neurinoma dell’acustico, lo schwannoma o aneurismi.
Tra le malattie sistemiche che più frequentemente si associano a cheratite neurotrofica va ricordato il diabete,che determina dei cambiamenti metabolici in grado di modificare tutte le strutture corneali tra cui l’epitelio, l’endotelio edi nervi. In particolare, è stata descritta una maggiore permeabilità epiteliale, una diminuzione della adesione cellulare e la densità cellulare nei pazienti diabetici associati ad alterazione della morfologia dei nervi sub-basali corneali, con diminuzione della sensibilità corneale dovuta alla neuropatia diabetica. (12-14)
Ruolo dei nervi corneali nella patogenesi della cheratite neurotrofica
Il principale meccanismo patogenetico che porta allo sviluppo della cheratite neurotrofica è la perdita parziale o totale dell’innervazione corneale con la conseguente mancanza di supporto trofico dei tessuti corneali. Infatti i nervi sensitivi corneali rilasciano mediatori solubili e fattori di crescita che sostengono la sopravvivenza delle cellule corneali. La mancanza di tale supporto provoca cambiamenti metabolici, morfologici e funzionali delle cellule epiteliali corneali, che inducono la formazione di difetti epiteliali corneali e ulcere indolenti. (15, 16)
L’innervazione trigeminale fornisce la sensibilità corneale a stimoli meccanici, chimici e termici. I nervi corneali reagiscono agli stimoli nocivi esterni e alle lesioni della superficie oculare inducendo dolore o irritazione oculare e provocando i riflessi protettivi dellalacrimazione e dell’ammiccamento.
La riduzione del supporto trofico fornito dai nervi corneali, associata alla conseguente diminuzione del riflesso lacrimale può determinare lo sviluppo della cheratite neurotrofica. Molti studi hanno anche evidenziato una stretta interazione tra i nervi corneali, le cellule epiteliali corneali e i cheratociti, che interagiscono reciprocamente attraverso il rilascio di mediatori solubili e fattori di crescita. Infatti, i terminali nervosi corneali rilasciano neuropeptidi e neuromeditoriquali l’Acetilcolina, la Sostanza P, il neuropeptive Y (NPY), e il calcitonine-gene related peptide (CGRP) che sono in grado di modulare la proliferazione, la differenziazione delle cellule corneali e promuovere il mantenimento dell’integrità e il rinnovamento dei tessuti. (1, 16) Le cellule dell’epitelio corneale ed i cheratociti, a loro volta, producono e rilasciano fattori di crescita come il nerve growth factor (NGF), il brain derived neurotrophic factor (BDNF), il ciliary neurotrophic factor (CNTF), la neurotrofina 3 e 4/5 che stimolano la sopravvivenza, la maturazione e la crescita dei nervi. Tale interazione tra nervi e cellule corneali è quindi fondamentale per il mantenimento dell’integrità e della funzione corneale. (1, 15)
Presentazione clinica della cheratite neurotrofica
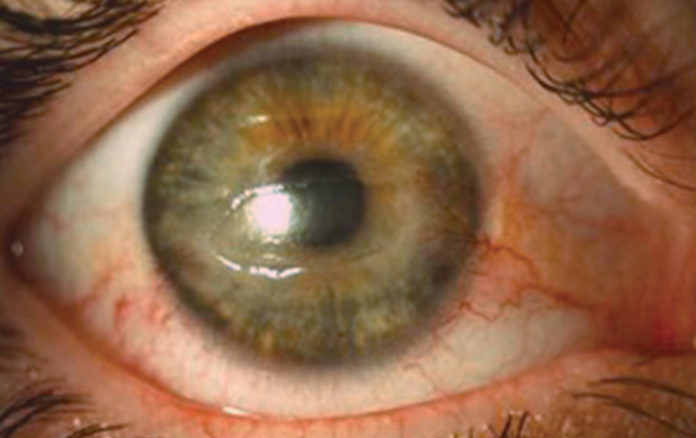
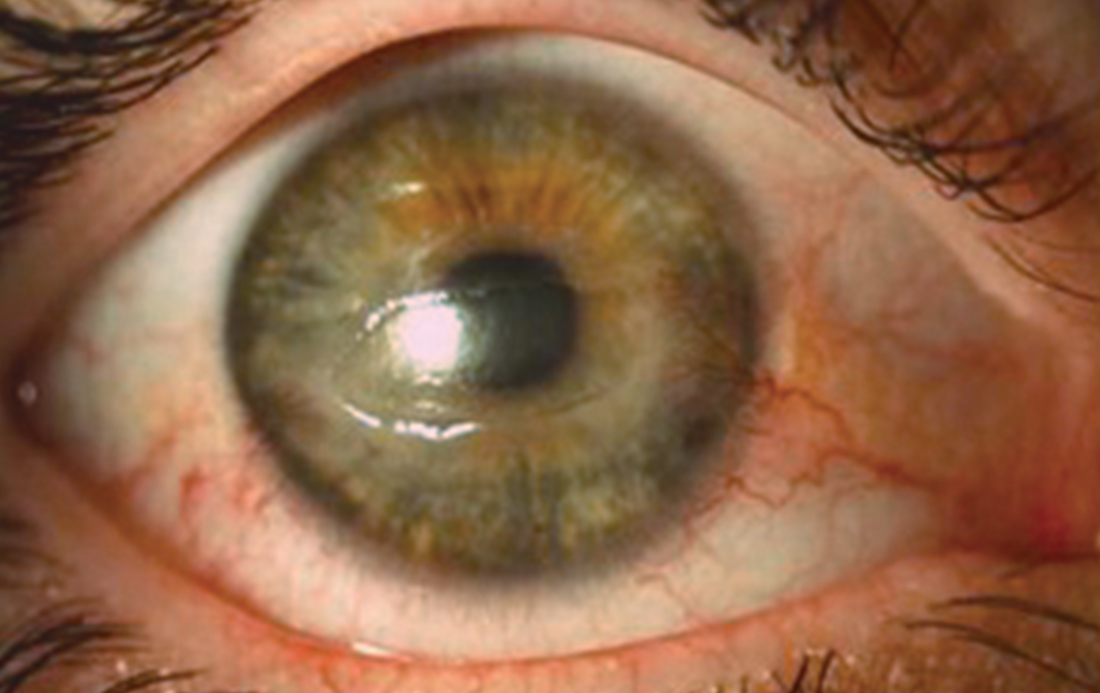
La presentazione clinica della cheratite neurotrofica è caratterizzata dalla diminuzione o assenza di sensibilità corneale associata ad alterazioni corneali che vanno dall’ aspetto grigiastro e distrofico dell’epitelio corneale, alla presenza di cheratite puntata superficiale (SPK), di difetti epiteliali ricorrenti e/o persistenti (PED), fino all’ulcera stromale, la necrosi asettica corneale e la perforazione. (Fig. 1) La compromissione del riflessolacrimale determina anche una riduzione della produzione e della funzione lacrimale nei pazienti con cheratite neurotrofica. (2, 3)
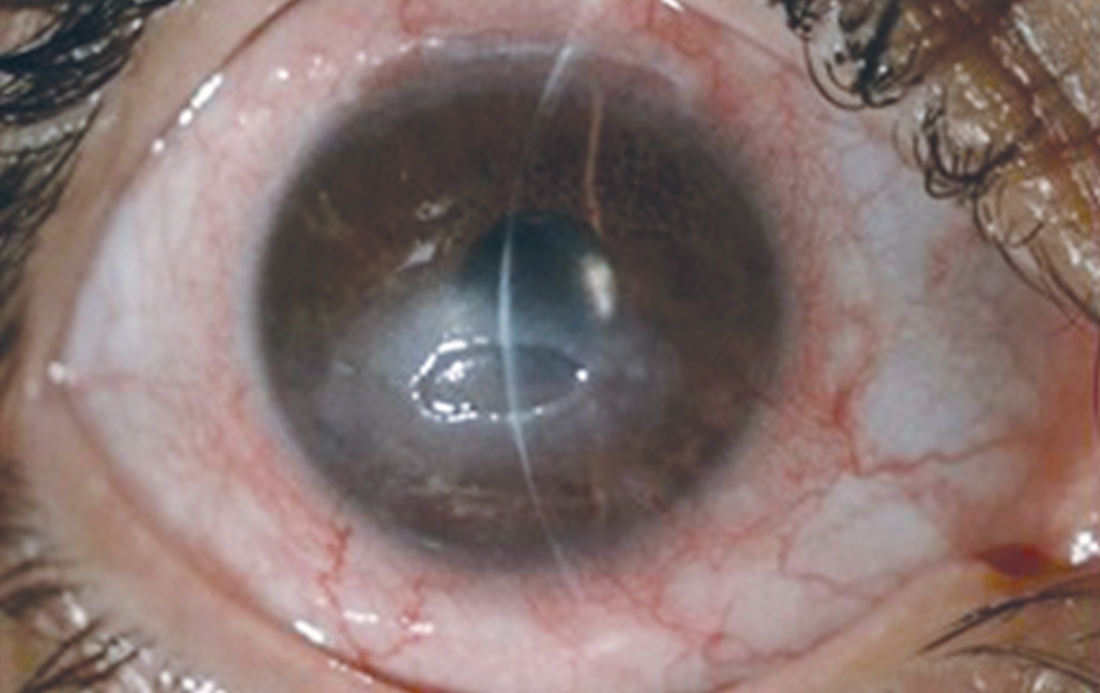
I pazienti con cheratite neurotrofica possono presentarsi senza sintomi oculari poiché hanno una ridotta o assente sensibilità corneale, mentre a volte possono lamentare unariduzione della funzione visiva legata alla presenza dei difetti epiteliali. Raramente possono presentare una lieve iperemia congiuntivale e quindi riferiscono arrossamento oculare. La mancanza o scarsità di sintomi può far si che il paziente con cheratite neurotrofica giunga all’osservazione dell’oculista solo nelle fasi finali della malattia. Inoltre, poiché questi pazienti sono per nulla o poco sintomatici, è necessario un rigoroso monitoraggio anche dopo la diagnosi di cheratite neurotrofica, in quanto potrebbero non essere in grado di accorgersi di un peggioramento delle condizioni oculari.
La presenza di cheratite neurotrofica dovrebbe essere sospettata in tutti i pazienti con difetti epiteliali o ulcere corneali non infettive, con scarsa tendenza alla guarigione spontanea, associati a sintomi lievi o assenti di discomfort oculare. Tale sospetto deve portare sempre alla valutazione della sensibilità corneale. Infatti la caratteristica patognomonica della cheratite neurotrofica è ladiminuzione o assenza di sensibilità corneale. In questi pazienti il riscontro di ipo/anestesia corneale confermerà la diagnosi di cheratite neurotrofica.
Classificazione della cheratite neurotrofica
Attualmente la cheratite neurotrofica è classificata sulla base della severità clinica usando la classificazione Mackie. In particolare, la cheratite neurotrofica allo stadio 1 è caratterizzata dalla presenza di epitelio corneale irregolare e grigiastro e/o dalla presenza di SPK. Nelle forme di lunga durata è possibile osservare anche la presenza di neovascolarizzazione corneale superficiale, leucomi ed edema corneale. La cheratite neurotrofica allo stadio 2 è caratterizzata dallo sviluppo di un difetto epiteliale corneale. Raramente, è possibile osservare una reazione in camera anteriore con flare e/o ipopion sterile. La cheratite neurotrofica nello stadio 3 è la forma più severa ed è caratterizzata da coinvolgimento della stroma corneale con sviluppo di ulcera corneale, che può progredire, se non trattata, sino alla perforazione. (2)
Diagnosi della cheratite neurotrofica
Anamnesi
La raccolta accurata della storia clinica del paziente contribuirà ad identificare la presenza di condizioni che possono associarsi ad un danno trigeminale. In particolare, si devono indagare la presenza di malattie sistemiche come il diabete o la sclerosi multipla e la storia di uso di farmaci neurotossici quali farmaci antipsicotici o neurolettici. Deve essere indagata anche la presenza di patologie cerebrali che possono danneggiare il nervo trigemino quali tumori, pregressa neurochirurgia o ischemia cerebrale. Occorre inoltre studiare la storia clinica oculare per identificare le possibili condizioni che possono danneggiare l’innervazione corneale, come ad esempio pregresse infezioni corneali, l’uso cronico di farmaci topici, l’uso di lenti a contatto, pregressa chirurgia oculare o eventi traumatici come ustioni o causticazioni. (2, 3)
Esame obiettivo
L’esame obiettivo può consentire di individuare altre condizioni che possono danneggiare il nervo trigemino, e deve essere prestata particolare attenzione alla presenza di disfunzioni dei nervi cranici che possono indicare la presenza di un neurinoma dell’acustico, aneurismi o danni neurochirurgici.
La presenza di alterazioni delle palpebre quali il lagoftalmo possono contribuire all’identificazione di condizioni associate a danni al trigemino,come la paralisi del faciale, e che possono peggiorare la prognosi della cheratite neurotrofica per la presenza di cheratite da esposizione. (3, 4)
All’esame alla lampada a fessura in presenza di cheratite neurotrofica, la cornea mostra alterazioni epiteliali che vanno, in base allo stadio, dall’epitelio irregolare egrigiastro, alla presenza di SPK, di difetti epiteliali e di ulcera corneale. Solitamente, i difetti epiteliali di origine neurotrofica si presentano di forma ovale o circolare, localizzati nell’area corneale centrale, circondati da un’area di epitelio opaco e poco aderente che tende ad arrotolarsi ai bordi della lesione. Nelle forme di lunga durata è possibile osservare la presenza di neovascolarizzazione corneale e di leucomi. La congiuntiva mostra raramente segni di reazione infiammatoria, tuttavia, l’iperemia congiuntiva lieve può essere osservata in presenza di difetti epiteliali. (Fig. 1) L’esame della camera anteriore può consentire di identificare la presenza di flare e/o ipopion (sterile).
Colorazioni vitali. La colorazione della superficie oculare con fluoresceina o verde di lissamina consentiranno di caratterizzare la presenza e la dimensione dei difetti epiteliali e di classificare la severità della cheratite neurotrofica.
In presenza di iperemia congiuntivale severa e secrezione, associate a difetti epiteliali corneali o ulcere con infiltrato corneale e/o reazione in camera anteriore, si deve sospettare una sovrainfezione e devono essere effettuati gli esami microbiologici oculari. L’esame del fundus oculare contribuirà alla caratterizzazione della cheratite neurotrofica permettendo di identificare l’eventuale presenza di retinopatia diabetica o di alterazionidel nervo ottico ottici come il papilledema o l’atrofia ottica che possono essere associati a patologie cerebrali.
Misurazione della sensibilità corneale.Per confermare la diagnosi di cheratite neurotrofica occorre valutare la sensibilità corneale. Infatti, l’identificazione della diminuzione o assenza della sensibilità corneale consente di confermare la diagnosi di cheratite neurotrofica. (3, 4) La sensibilità corneale può essere valutata qualitativamente sfiorando la cornea con la punta di un tampone o un filo di cotone: la risposta del paziente e/o la reazione di ammiccamento confermano la presenza o l’assenza di sensibilità corneale. (2) La sensibilità corneale può essere quantificata attraverso l’utilizzo di strumenti detti estesiometri corneali. Il più utilizzato nella pratica clinica è l’estesiometro di Cochet-Bonnet che misura la sensibilità meccanica corneale. (2) In particolare, la superficie corneale viene toccata con la punta di un filamento di nylon e la lunghezza del filamento (da 0 a 6 centimetri) necessaria per indurre una risposta del paziente o l’ammiccamento misura la sensibilità corneale che può essere espressa in centimetri. Altri dispositivi che consentono di valutare la sensibilità meccanica, chimica e termica sulla superficie oculare sono stati sviluppati recentemente ed il loro impiego nella pratica clinica è ancora limitato. (2) Tra questi, l’estesiometro di Belmonte e la sua versione modificata consentono di valutare la sensibilità corneale stimolando la cornea con un getto di aria o gas. (17-19)
Esami aggiuntivi
Ulteriori esami dovrebbero essere eseguiti nel paziente con cheratite neurotrofica per valutare la funzione lacrimale, come il test di Schirmer e il break-up time test (TFBUT). Infatti, la diminuzione della sensibilità corneale è associata alla diminuzione della produzione di lacrime e della stabilità del film lacrimale, legate alla diminuzione del riflesso lacrimale. Inoltre la presenza e la gravità delle alterazioni della funzione lacrimale peggiorano la prognosi della cheratite neurotrofica. (3)
La microscopia confocale corneale in vivo viene utilizzata nei pazienti con cheratite neurotrofica per valutare le alterazioni delle cellule corneali e la morfologia dei nervi corneali. Questa indagineviene utilizzata nella pratica clinica per valutare la densità e la morfologia del plesso corneale sub-basale in diverse condizioni associate a compromissione della sensibilità corneale, tra cui la cheratite neurotrofica, e consente di quantificare la densità e la morfologia delle cellule e dei nervi corneali. (20)
Conclusioni
La cheratite neurotrofica è una patologia rara e degenerativa associata a compromissione dell’innervazione sensoriale corneale. È caratterizzata da diminuzione o assenza di sensibilità corneale associata ad alterazioni epiteliali corneali che possono portare allo sviluppo di difetti epiteliali e ulcere corneali con scarsa tendenza alla guarigione, e progredire fino alla perforazione corneale. La gestione della cheratite neurotrofica richiede un’identificazione e una diagnosi precoci, un monitoraggio accurato dei pazienti e un trattamento tempestivo per stimolare la riparazione corneale e prevenire la progressione della malattia. È quindi fondamentale, in presenza di un difetto epiteliale o un ulcera corneale non infettivi, sospettare la presenza della cheratite neurotrofica e testare la sensibilità corneale.
Bibliografia
- Mastropasqua L, Massaro-Giordano G, Nubile M, Sacchetti M: Understanding the Pathogenesis of Neurotrophic Keratitis: The Role of Corneal Nerves. Journal of cellular physiology 2016.
- Bonini S, Rama P, Olzi D, Lambiase A: Neurotrophic keratitis. Eye 2003, 17(8):989-995.
- Sacchetti M, Lambiase A: Diagnosis and management of neurotrophic keratitis. Clinical ophthalmology 2014, 8:571-579.
- Semeraro F, Forbice E, Romano V, Angi M, Romano MR, Filippelli ME, Di Iorio R, Costagliola C: Neurotrophic keratitis. Ophthalmologica Journal international d’ophtalmologie International journal of ophthalmology Zeitschrift fur Augenheilkunde 2014, 231(4):191-197.
- Chucair-Elliott AJ, Zheng M, Carr DJ: Degeneration and regeneration of corneal nerves in response to HSV-1 infection. Investigative ophthalmology & visual science 2015, 56(2):1097-1107.
- Miller CS, Danaher RJ, Jacob RJ: Molecular aspects of herpes simplex virus I latency, reactivation, and recurrence. Critical reviews in oral biology and medicine : an official publication of the American Association of Oral Biologists 1998, 9(4):541-562.
- Dworkin RH, Johnson RW, Breuer J, Gnann JW, Levin MJ, Backonja M, Betts RF, Gershon AA, Haanpaa ML, McKendrick MW et al: Recommendations for the management of herpes zoster. Clinical infectious diseases : an official publication of the Infectious Diseases Society of America 2007, 44 Suppl 1:S1-26.
- Hamrah P, Cruzat A, Dastjerdi MH, Zheng L, Shahatit BM, Bayhan HA, Dana R, Pavan-Langston D: Corneal sensation and subbasal nerve alterations in patients with herpes simplex keratitis: an in vivo confocal microscopy study. Ophthalmology 2010, 117(10):1930-1936.
- Calvillo MP, McLaren JW, Hodge DO, Bourne WM: Corneal reinnervation after LASIK: prospective 3-year longitudinal study. Investigative ophthalmology & visual science 2004, 45(11):3991-3996.
- Patel SV, McLaren JW, Hodge DO, Bourne WM: Confocal microscopy in vivo in corneas of long-term contact lens wearers. Investigative ophthalmology & visual science 2002, 43(4):995-1003.
- Sacchetti M, Lambiase A, Cortes M, Sgrulletta R, Bonini S, Merlo D, Bonini S: Clinical and cytological findings in limbal stem cell deficiency. Graefe’s archive for clinical and experimental ophthalmology = Albrecht von Graefes Archiv fur klinische und experimentelle Ophthalmologie 2005, 243(9):870-876.
- Hyndiuk RA, Kazarian EL, Schultz RO, Seideman S: Neurotrophic corneal ulcers in diabetes mellitus. Archives of ophthalmology 1977, 95(12):2193-2196.
- Hsu HY, Modi D: Etiologies, Quantitative Hypoesthesia, and Clinical Outcomes of Neurotrophic Keratopathy. Eye & contact lens 2015, 41(5):314-317.
- Lockwood A, Hope-Ross M, Chell P: Neurotrophic keratopathy and diabetes mellitus. Eye 2006, 20(7):837-839.
- Muller LJ, Marfurt CF, Kruse F, Tervo TM: Corneal nerves: structure, contents and function. Experimental eye research 2003, 76(5):521-542.
- Shaheen BS, Bakir M, Jain S: Corneal nerves in health and disease. Survey of ophthalmology 2014, 59(3):263-285.
- Belmonte C, Aracil A, Acosta MC, Luna C, Gallar J: Nerves and sensations from the eye surface. The ocular surface 2004, 2(4):248-253.
- Golebiowski B, Lim M, Papas E, Stapleton F: Understanding the stimulus of an air-jet aesthesiometer: computerised modelling and subjective interpretation. Ophthalmic & physiological optics : the journal of the British College of Ophthalmic Opticians 2013, 33(2):104-113.
- Golebiowski B, Papas E, Stapleton F: Assessing the sensory function of the ocular surface: implications of use of a non-contact air jet aesthesiometer versus the Cochet-Bonnet aesthesiometer. Experimental eye research 2011, 92(5):408-413.
- Lambiase A, Sacchetti M, Mastropasqua A, Bonini S: Corneal changes in neurosurgically induced neurotrophic keratitis. JAMA ophthalmology 2013, 131(12):1547-1553.