INTRODUZIONE
I progressi nella medicina dei trapianti hanno sensibilmente migliorato la prognosi dei pazienti sottoposti a trapianto allogenico di cellule staminali ematopoietiche, portando ad un significativo incremento dell’aspettativa di vita e ad una riduzione della mortalità legata al trapianto (1). L’aumento del tasso di successo di trapianto e del numero globale di pazienti sottoposti a tale procedura hanno però incrementato l’incidenza di malattia del trapianto contro l’ospite (Graft-versus-Host Disease, GVHD) (2, 3).
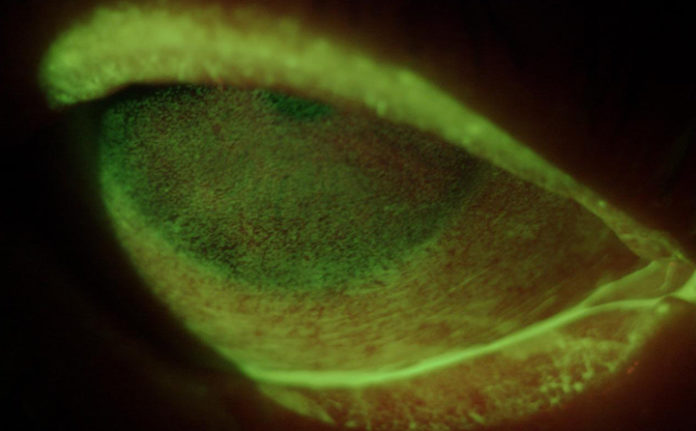
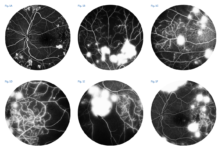
Lo spettro della GVHD oculare può variare da una sindrome da disfunzione lacrimale di lieve entità fino a complicanze severe e permanenti a carico del sistema della superficie oculare, anche in assenza di GVHD sistemica (figg. 1 e 2) (4, 5).
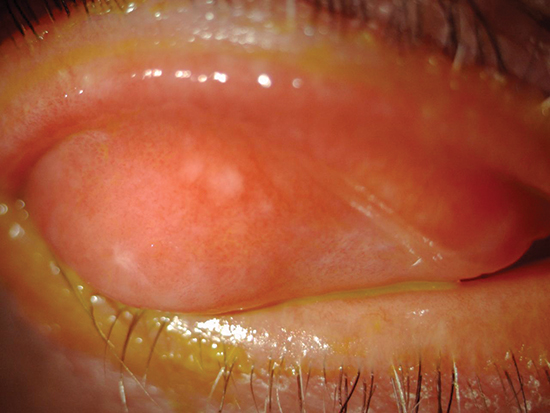
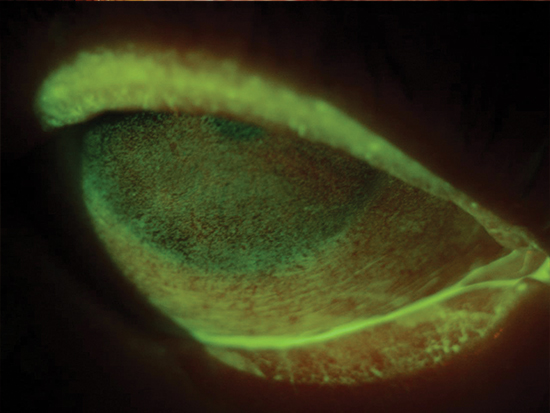
L’osmolarità lacrimale è riconosciuta come un fattore centrale nella patogenesi della sindrome da disfunzione lacrimale (6, 7). L’iperosmolarità del film lacrimale viene infatti considerata come un marcatore globale di entrambi i sottotipi della malattia da occhio secco, da ridotta produzione e da aumentata evaporazione (8).
Attualmente, la diagnosi e la valutazione del grado di severità della sindrome da disfunzione lacrimale sono basate sui sintomi (questionario OSDI) e su test diagnostici quali il test di Schirmer, il tempo di rottura del film lacrimale (TBUT), le colorazioni vitali corneali e congiuntivali. Tuttavia, queste metodiche forniscono risultati soggetti a variazioni intra e interoperatore.
Numerosi studi hanno indicato che la misurazione dell’osmolarità lacrimale rappresenta il test singolo più sensibile e specifico nella diagnosi di malattia da occhio secco (9). Grazie alla recente disponibilità di osmometri utilizzabili nella pratica clinica, è possibile misurare l’osmolarità lacrimale in vivo. Il valore di cut-off pari a 308 mOsm/l rappresenta il limite più sensibile di osmolarità lacrimale nell’identificazione della sindrome da disfunzione lacrimale (7). Sono stati pubblicati lavori scientifici che hanno mostrato un’aumentata osmolarità lacrimale in condizioni della superficie oculare legate alla malattia da occhio secco: sindrome di Sjogren (10, 11), pterigio corneale (12), inquinamento atmosferico (13), oftalmopatia tiroidea (14), pemfigoide oculare cicatriziale (15) e in pazienti in terapia cronica con colliri ipotonizzanti per glaucoma (16).
Lo scopo di questo studio è valutare il ruolo dell’osmolarità lacrimale nei pazienti affetti da GVHD oculare in relazione ai test diagnostici standard della malattia da occhio secco: test di Schirmer, tempo di rottura del film lacrimale (Tear film Break Up Time, TBUT), questionario sui sintomi (Ocular Surface Disease Index, OSDI), colorazioni vitali della cornea e della congiuntiva.
materiali e metodi
Sono stati sottoposti a visita di screening 71 pazienti affetti da GVHD oculare; 56 di essi rispettavano tutti i criteri di inclusione e non incontravano alcun criterio di esclusione, e sono stati quindi arruolati nello studio. Le procedure e i test diagnostici specifici per la malattia dell’occhio secco in corso di GVHD oculare sono stati eseguiti nel seguente ordine in modo da assicurare risultati indipendenti tra i test:
questionario sui sintomi (Ocular Surface Disease Index, OSDI);
misurazione dell’osmolarità lacrimale;
test di Schirmer di tipo I, senza utilizzo di anestesia topica;
misurazione del tempo di rottura del film lacrimale (Tear film Break Up Time, TBUT);
colorazione vitale corneale con fluoresceina secondo la scala Oxford.
colorazione vitale congiuntivale con verde lissamina secondo il punteggio di Van Bijsterveld.
I 56 soggetti (23 femmine, 33 maschi) avevano un’età media pari a 47 anni. Tutti gli arruolati presentavano una GVHD sistemica conclamata. Lo studio è stato condotto a 3.0 ± 2.8 anni dal trapianto.
RISULTATI
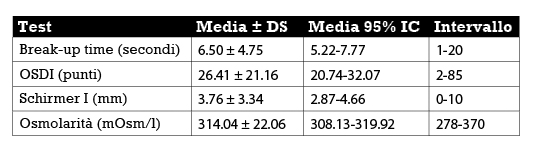
I risultati dei test diagnostici specifici per la malattia da occhio secco sono riportati nella tabella 1.
L’osmolarità lacrimale ha mostrato una correlazione negativa statisticamente significativa con il tempo di rottura del film lacrimale o TBUT (r2 = 0.68; coefficiente di correlazione = -0.728; p<0.001, fig. 3A).
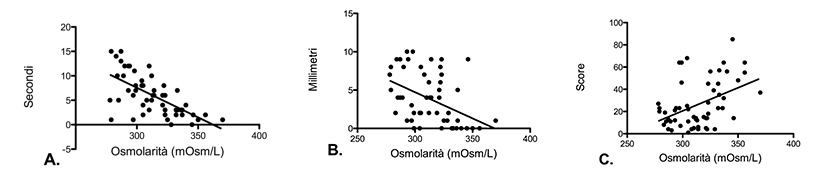
Una correlazione negativa statisticamente significativa, anche se in misura minore rispetto a quella precedente, è stata riscontrata tra osmolarità lacrimale e test di Schirmer (r2 = 0.203; coefficiente di correlazione = -0.476; p<0.001, fig. 3B). Una correlazione positiva statisticamente significativa, anche se in misura minore rispetto a quella tra osmolarità e TBUT, è stata inoltre rilevata tra osmolarità e OSDI (r2 = 0.188; coefficiente di correlazione = 0.455; p<0.001, fig. 3C).
Analizzando il rapporto tra osmolarità lacrimale e colorazione corneale con fluoresceina, l’osmolarità è variata in maniera statisticamente significativa (p=0.0006) nei diversi sottogruppi della classificazione di Oxford: 305.4 ± 17.73 mOsm/l nel gruppo con staining corneale lieve (36 occhi), 330.6 ± 13.61 mOsm/l nel gruppo con staining corneale moderato (8 occhi), e 329.1 ± 23.99 mOsm/l nel gruppo con staining corneale severo (12 occhi). Analogamente, prendendo in esame il rapporto tra osmolarità lacrimale e colorazione congiuntivale con verde lissamina, l’osmolarità è variata in maniera statisticamente significativa (p=0.0006) nei diversi sottogruppi classificativi della scala di Van Bijsterveld: 307.5 ± 18.57 mOsm/l nel gruppo con colorazione congiuntivale lieve (39 occhi), 327.8 ±2 6.48 mOsm/l nel gruppo con colorazione congiuntivale moderata (6 occhi), e 329.8 ±2 1.40 mOsm/l nel gruppo con colorazione congiuntivale severa (11 occhi).
Non sono state invece riscontrate correlazioni statisticamente significative tra il questionario sui sintomi (OSDI) ed il tempo di rottura del film lacrimale (TBUT, r2 = 0.27; coefficiente correlazione = -0.563), e tra il questionario sui sintomi (OSDI) ed il test di Schirmer (r2 = 0.35; coefficiente di correlazione = -0.646). Infine, il tempo di rottura del film lacrimale (TBUT) ha mostrato una debole correlazione statistica con il test di Schirmer (r2 = 0.14; coefficiente di correlazione = 0.44).
CONCLUSIONI
In conclusione, la GVHD oculare rappresenta una delle cause più severe di sindrome da disfunzione lacrimale e si può manifestare anche in assenza di GVHD sistemica. Questo studio evidenzia un’iper-osmolarità lacrimale nei pazienti affetti da GVHD oculare. L’osmolarità lacrimale presenta una correlazione statisticamente significativa con il tempo di rottura del film lacrimale (TBUT) e, in misura minore, con il test di Schirmer, evidenziando il ruolo delle componenti da ridotta produzione e da aumentata evaporazione nella sindrome da disfunzione lacrimale in corso di GVHD oculare. La misurazione dell’osmolarità lacrimale può avere un ruolo nella diagnosi della GVHD oculare, tuttavia è consigliabile utilizzarla in associazione alle metodiche diagnostiche standard.
BIBLIOGRAFIA
- Ferrara JL, Levine JE, Reddy P et al. Graft-versus-host disease. Lancet 2009;373:1550-61.
- Flowers ME, Parker PM, Johnston LJ et al. Comparison of chronic graft-versus-host disease after transplantation of peripheral blood stem cells versus bone marrow in allogeneic recipients: long-term follow-up of a randomized trial. Blood 2002;100:415-9.
- Filipovich AH, Weisdorf D, Pavletic S et al. National Institute of Health consensus development project on criteria for clinical trials in chronic-graft-versus-host disease: I. Diagnosis and staging working group report. Biol Blood Marrow Transplant 2005;11:945-56.
- Shikari H, Antin JH, Dana R. Ocular graft-versus-host-disease: a review. Surv Ophthalmol 2013;58:233-51.
- Balaram M, Rashid S, Dana R. Chronic ocular surface disease after allogeneic bone marrow transplantation. Ocul Surf 2005;3:203-11.
- Report of the International Dry Eye WorkShop (DEWS) 2007. Ocul Surf 2007;5:1-204.
- Lemp MA, Bron AJ, Baudouin C, et al. Tear osmolarity in the diagnosis and management of dry eye disease. Am J Ophthalmol 2011;151:792-8.
- Liu H, Begley C, Chen M et al. A link between tear instability and hyperosmolarity in dry eye. Invest Ophthalmol Vis Sci 2009;50:3671-9.
- Tomlinson A, Khanal S, Ramaesh K et al. Tear film osmolarity: determination of a referent for dry eye diagnosis. Invest Ophthalmol Vis Sci 2006;47:4309-15.
- Bunya VY, Langelier N, Chen S et al. Tear osmolarity in Sjögren syndrome. Cornea 2013;32:922-7.
- Utine CA, Bicakcigil M, Yavuz S et al. Tear osmolarity measurements in dry eye related to primary Sjögren syndrome. Curr Eye Res 2011;36:683-90.
- Julio G, Lluch S, Pujol P et al. Tear osmolarity and ocular changes in pterygium. Cornea 2012;31:1417-21.
- Torricelli AM, Novaes P, Matsuda M et al. Correlation between signs and symptoms of ocular surface dysfunction and tear osmolarity with ambient levels of air pollution in a large metropolitan area. Cornea 2013;32:e11-15.
- Iskeleli G, Karakoc Y, Abdula A. Tear film osmolarity in patients with thyroid ophthalmopathy. Jpn J Ophthalmol 2008;52:323-6.
- Miserocchi E, Iuliano L, Berchicci L et al. Tear film osmolarity in ocular mucous membrane pemphigoid. Cornea 2014;33:668-72.
- Labbé A, Terry O, Brasnu E et al. Tear film osmolarity in patients treated for glaucoma or ocular hypertension. Cornea 2012;31:9:994-9.