La superficie oculare, dalla nascita e per tutta la durata della vita, è continuamente esposta all’ambiente esterno e dunque a diversi tipi di microbi (1).
I recenti progressi nella conoscenza del microbioma umano, della sua importanza nel mantenimento dell’omeostasi che caratterizza i distretti mucosi e cutanei sani e del suo potenziale ruolo in molteplici patologie, hanno portato a studiare sotto questa nuova luce la superficie oculare (1,2).
Gli aspetti di maggior interesse sono la presenza di un vero microbioma oculare stabilmente residente, la sua potenziale relazione con patologie infettive ed infiammatorie (o “idiopatiche”) della superficie oculare e la possibilità di intervenire sul microbioma per migliorare lo stato di salute della superficie oculare (2).
Il microbioma della superficie oculare umana
I primi studi, basati esclusivamente su colture batteriche seminate in diversi terreni, avevano mostrato una scarsa colonizzazione batterica della superficie oculare umana in condizioni fisiologiche.
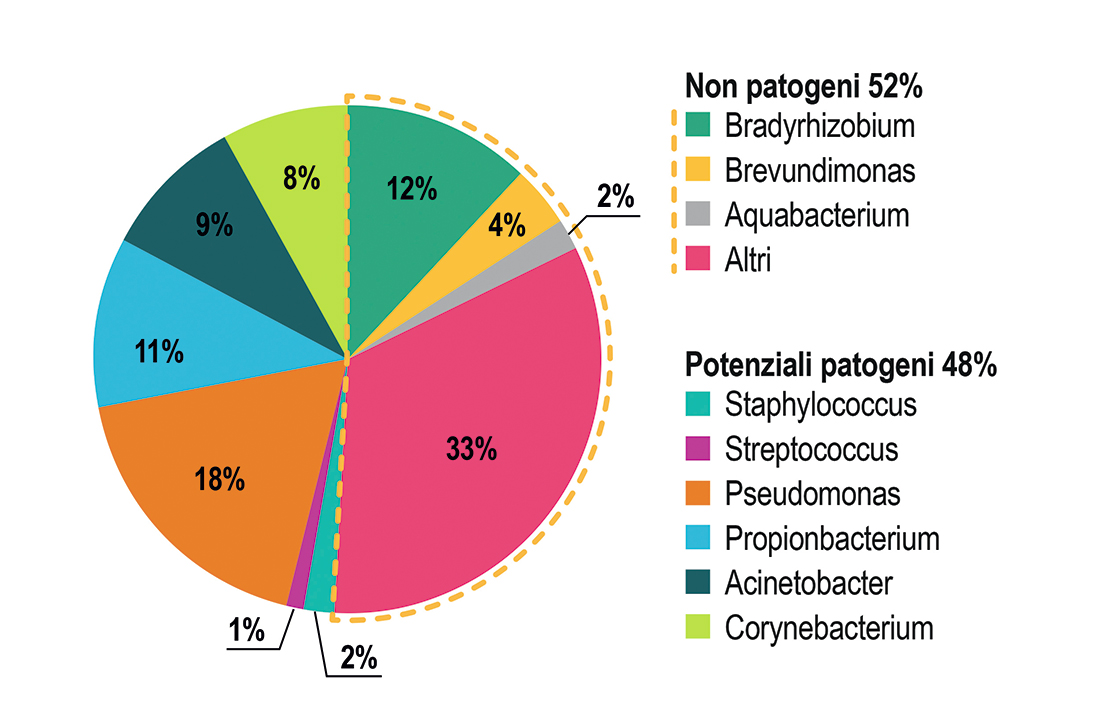
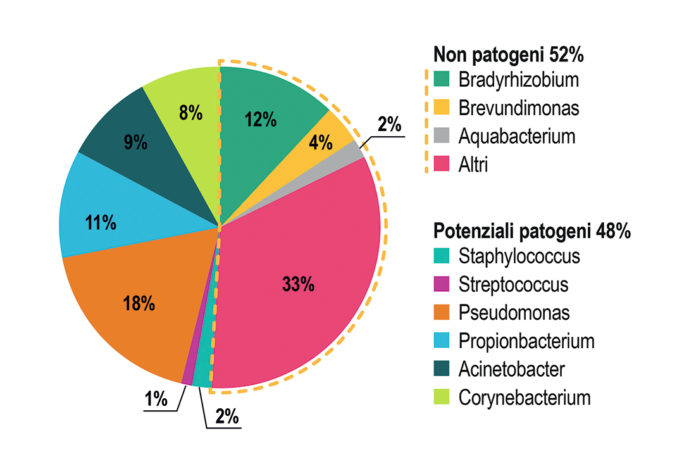
Gli studi colturali hanno mostrato che i batteri più frequentemente coltivabili ottenuti da tamponi della superficie oculare sono stafilococchi coagulasi-negativi (20-80% di colture positive da campioni congiuntivali e 30-100% da campioni palpebrali), Propionibacterium sp. e Corynebacterium sp (1).
Tuttavia i batteri coltivabili rappresentano solo una frazione dei microbi che possono colonizzare l’uomo e studi di metagenomica hanno dimostrato che il numero di cellule microbiche presenti su o in un essere umano è circa 10 volte superiore al numero di cellule umane presenti in tutto il corpo (1,2,3).
L’applicazione di queste tecniche allo studio del microbioma della superficie oculare ha permesso di identificare un’ampia varietà di batteri, virus e funghi non coltivabili con tecniche tradizionali (4-8).
Dati molto recenti hanno mostrato sovrapponibilità tra il microbioma della superficie oculare dei 2 occhi di un individuo sano ed interessanti correlazioni tra le caratteristiche della popolazione microbica, il sesso e l’età degli individui (9).
Attualmente gli sforzi principali della ricerca si stanno concentrando sulla caratterizzazione dettagliata e la valutazione della stabilità del microbioma della superficie oculare, sul raffronto tra le sue caratteristiche e quelle di altri microbiomi al momento meglio conosciuti (ad esempio quello intestinale o quello del cavo orale) e sul suo rapporto con diverse condizioni patologiche (2).
Impatto del microbioma sull’immunità della superficie oculare umana
Alcuni studi condotti su pazienti con dry eye, associato o meno a patologie autoimmuni (4,10), mostrando delle alterazioni nel microbioma della superficie oculare di questi pazienti, supportano l’esistenza di una relazione tra microbioma e stato di salute della superficie oculare.
Recentemente, inoltre, un interessante modello sperimentale messo a punto all’Università di Harward, servendosi di topi “germ-free” e di topi sottoposti a terapie antibiotiche topiche o sistemiche, ha dimostrato che la deplezione del microbioma della superficie oculare aumenta la suscettibilità alle cheratiti da Pseudomonas aeruginosa (11).
Uno dei meccanismi principali con cui, in diversi siti mucosi, i microbi commensali esercitano un effetto protettivo è quello della competizione con i microbi patogeni (12).
La scarsa carica batterica della superficie oculare umana, tuttavia, porta ad ipotizzare un depotenziamento di questo meccanismo a favore di un effetto regolatorio del microbioma sull’immunità locale (13).
Un numero crescente di recenti evidenze sperimentali stanno aumentando la nostra conoscenza di come microbioma oculare e microbioma intestinale, con meccanismi e pathways differenti, contribuiscano alla regolazione dell’immunità della superficie oculare, mostrando un impatto significativo sulla produzione di IgA, sull’immunità innata e sull’autoimmunità (13).
Microbioma, probiotici, paraprobiotici ed allergie
Negli ultimi anni la letteratura scientifica ha riportato un grande numero di evidenze a supporto di un ruolo del microbioma intestinale e cutaneo nella regolazione delle risposte immuni di tipo 2 e nello sviluppo delle allergie, dalla dermatite atopica alle allergie alimentari e respiratorie (14).
Queste evidenze hanno portato a numerosi studi volti a migliorare il microbioma (prevalentemente intestinale) di pazienti allergici o a rischio di sviluppare allergie tramite la supplementazione alimentare con probiotici e prebiotici (15).
L’entusiasmo per le promettenti prospettive nate dalla possibilità di intervenire in questo modo sul microbioma e la sostanziale assenza di preoccupazioni inerenti la safety, hanno recentemente portato la World Allergy Organization a raccomandare questo tipo di supplementazione dietetica nei bambini ad alto rischio di sviluppare allergie e nelle loro madri durante gravidanza ed allattamento (16).
I probiotici sono attualmente definiti come “microorganismi viventi che, quando ingeriti in quantità adeguata, conferiscono un effetto benefico all’ospite” (17).
Recenti evidenze, tuttavia, hanno mostrato come anche lisati cellulari e cellule microbiche non viventi possano avere un impatto “probiotico” sulla regolazione dell’immunità locale.
Questo ha portato alla formulazione della definizione di paraprobiotici come “cellule microbiche inattivate o frazioni cellulari in grado di avere un effetto benefico sulla salute del soggetto a cui vengono somministrate” (18,19).
Approcci probiotici alternativi alla supplementazione dietetica sono stati tentati con risultati interessanti, soprattutto nell’uso topico di differenti tipi di Lactobacillus.
Park SB e colleghi, in un Split-Body Clinical Trial randomizzato, hanno confrontato in pazienti con dermatite atopica l’efficacia dell’applicazione cutanea di emollienti tradizionali con quella di emollienti arricchiti con Lactobacillus sakei probio 65 (20).
Questo microorganismo è stato isolato dal kimchi, un cibo fermentato tradizionale koreano, ed è il ceppo di lactobacilli che in studi preclinici ha mostrato la maggior attività anti-Staphylococcus aureus e la maggior capacità di regolare la risposta immunitaria locale.
I risultati a 4 settimane di questo trial clinico hanno mostrato un’efficacia significativamente maggiore della formulazione contenente Lactobacillus sakei probio 65 nel controllo del prurito e nel miglioramento di parametri obbiettivabili come la “trans-epidermal water loss” e la “skin capacitance” (20).
Iovieno A. e colleghi, alcuni anni fa, hanno pubblicato uno studio clinico non controllato che forniva interessanti evidenze preliminari sulla possibilità di un approccio probiotico topico al trattamento della superficie oculare (21).
In questo studio condotto su bambini affetti da cherato-congiuntivite vernal lieve-moderata, 4 settimane di trattamento con un collirio contenente Lactobacillus Acidophilus diluito in soluzione salina hanno mostrato un miglioramento significativo di segni (iperemia congiuntivale e chemosi) e sintomi (fotofobia, prurito e lacrimazione) (21).
Nuovo paraprobiotico per uso oftalmico: caratteristiche e prime esperienze cliniche
Recentemente è stata messa a punto una nuova formulazione per uso oftalmico: un paraprobiotico topico.
Si tratta di una sospensione di lisato cellulare di Lactobacillus sakei probio 65 in un mezzo ottenuto dal sopranatante di colture del medesimo lactobacillo.
Al fine di massimizzare i benefici del trattamento, evitando effetti tossici o elementi in grado di interferire negativamente con il microbioma della superficie oculare, questa formulazione viene distribuita in un nuovo sistema multidose non conservato.
Questa tecnologia, di recente brevettazione e in grado di superare i test per i Criteri A della Farmacopea, si basa sull’integrazione nelle pareti del flacone di collirio di zeoliti in grado di fare da carrier per ioni Ag e Zn.
Questo nuovo sistema consente al tempo stesso di eliminare i conservanti dal collirio multidose e di minimizzare i rischi di contaminazione della porzione apicale del flacone, tipici dei sistemi “multidose non conservati”.
Una prima interessante area di applicazione di questa nuova formulazione è quella delle patologie allergiche.
I probiotici, infatti, tendono ad indurre una risposta immunitaria mediata prevalentemente da linfociti T-helper 1 e T-helper 3/T helper regolatori (Treg) che controbilanciano la risposta prevalentemente T-helper 2 mediata tipica della patologie allergiche (21).
In una prima esperienza clinica abbiamo trattato per 1 mese con questa nuova formulazione, da solo o in associazione con altre terapie, 15 pazienti affetti da diversi tipi di patologie allergiche della superficie oculare: congiuntivite stagionale o perenne e cheratocongiuntivite vernal.
Al momento, il limitato numero di pazienti trattati e l’eterogeneità delle forme cliniche rendono più rilevanti i dati su tollerabilità e sicurezza che non quelli inerenti l’efficacia. Nessuno di questi pazienti ha mostrato segni di tossicità o altre reazioni avverse obiettivabili e solo 1 su 15 ha riferito bruciore all’instillazione.
Un interessante riscontro ci è venuto da 3 pazienti con cheratocongiuntivite vernal in fase non attiva. Questi pazienti, durante i mesi di inattività della patologia, non instillavano alcuna terapia farmacologia ma mostravano una persistente lieve sintomatologia (fotofobia ed iperemia congiuntivale).
Dopo 4 settimane di trattamento con la formulazione paraprobiotica di Lactobacillus sakei probio 65, in assenza di altri provvedimenti terapeutici, questi pazienti hanno mostrato una sostanziale risoluzione dell’iperemia e riferito un significativa riduzione della sintomatologia irritativa residua.
Conclusioni
In conclusione, il rapporto tra microbioma, probiotici e patologia della superficie oculare è un tema affascinante, oggetto di un’attenzione crescente da parte della ricerca e ricco di possibili implicazioni fisiopatologiche, cliniche e terapeutiche.
La disponibilità di una formulazione paraprobiotica topica per uso oftalmico rappresenta un’interessante nuova risorsa, in grado di aprire una serie di nuove opzioni terapeutiche.
Le potenzialità di questo approccio nel trattamento esclusivo o ancillare di molte forme irritative ed infiammatorie “idiopatiche” della superficie oculare sono ancora ampiamente da esplorare.
- Willcox MD. Characterization of the normal microbiota of the ocular surface. Exp Eye Res. 2013 Dec;117:99-105.
- Zegans ME, Van Gelder RN. Considerations in understanding the ocular surface microbiome. Am J Ophthalmol. 2014 Sep;158(3):420-2.
- Turnbaugh PJ, Ley RE, Hamady M, Fraser-Liggett CM, Knight R, Gordon JI. The human microbiome project. Nature 2007;449, 804e810.
- Graham JE, Moore JE, Jiru X, et al. Ocular pathogen or commensal: a PCR-based study of surface bacterial flora in normal and dry eyes. Invest Ophthalmol Vis Sci. 2007;48(12):5616–5623.
- Dong Q, Brulc JM, Iovieno A, et al. Diversity of bacteria at healthy human conjunctiva. Invest Ophthalmol Vis Sci. 2011;52(8):5408–5413.
- Kaufman HE, Azcuy AM, Varnell ED, Sloop GD, Thompson HW, Hill JM. HSV-1 DNA in tears and saliva of normal adults. Invest Ophthalmol Vis Sci. 2005;46(1):241–247.
- Su CS, Bowden S, Fong LP, Taylor HR. Detection of hepatitis B virus DNA in tears by polymerase chain reaction. Arch Ophthalmol. 1994;112(5):621–625.
- Wu T, Mitchell B, Carothers T, et al. Molecular analysis of the pediatric ocular surface for fungi. Curr Eye Res. 2003; 26(1):33–36.
- Wen X, Miao L, Deng Y, et al. The Influence of Age and Sex on Ocular Surface Microbiota in Healthy Adults. Invest Ophthalmol Vis Sci. 2017 Dec 1;58(14):6030-6037.
- Albietz JM, Lenton LM. Effect of antibacterial honey on the ocular flora in tear deficiency and meibomian gland disease. Cornea. 2006; 25:1012–9.
- Kugadas A, Christiansen SH, Sankaranarayanan S, et al. Impact of Microbiota on Resistance to Ocular Pseudomonas aeruginosa-Induced Keratitis. PLoS Pathog. 2016 Sep 22;12(9):e1005855.
- Ivanov II, Honda K. Intestinal commensal microbes as immune modulators. Cell Host Microbe. 2012;12:496–508.
- Kugadas A, Gadjeva M. Impact of Microbiome on Ocular Health. Ocul Surf. 2016 Jul;14(3):342-9.
- McCoy KD, Ignacio A, Geuking MB. Microbiota and Type 2 immune responses. Curr Opin Immunol. 2018 Jun 1;54:20-27.
- Forsberg A, West CE, Prescott SL, Jenmalm MC. Pre- and probiotics for allergy prevention: time to revisit recommendations? Clin Exp Allergy. 2016 Dec;46(12):1506-1521.
- Fiocchi A, Pawankar R, Cuello-Garcia C et al. World Allergy Organization-McMaster University Guidelines for Allergic Disease Prevention (GLAD-P):probiotics. World Allergy Organ J. 2015; 8:4.
- FAO/WHO. Health and nutritional properties of probiotics in food including powder milk with live lacticacid bacteria. Report of a jointFAO/WHO expert consultation on evaluation of health and nutritional properties in food including powder milk with live lactic acid bacteria.,2001.
- Adams CA. The probiotic paradox: live and dead cells are biological response modifiers. Nutr Res Rev. 2010 Jun;23(1):37-46.
- Taverniti V, Guglielmetti S. The immunomodulatory properties of probiotic microorganisms beyond their viability (ghost probiotics: proposal of paraprobiotic concept). Genes Nutr. 2011 Aug;6(3):261-74.
- Park SB, Im M, Lee Y, et al. Effect of emollients containing vegetable-derived lactobacillus in the treatment of atopic dermatitis symptoms: split-body clinical trial. Ann Dermatol. 2014 Apr;26(2):150-5.
- Iovieno A, Lambiase A, Sacchetti M, Stampachiacchiere B, Micera A, Bonini S. Preliminary evidence of the efficacy of probiotic eye-drop treatment in patients with vernal keratoconjunctivitis. Graefes Arch Clin Exp Ophthalmol. 2008 Mar;246(3):435-41.
- Shigwedha N, Sichel L, Jia L, Zhang L, Probiotical Cell Fragments (PCFs) as “Novel Nutraceutical Ingredients” Journal of Biosciences and Medicines, 2014, 2, 43-55