Premessa: l’importanza della pressione di perfusione dell’arteria oftalmica nella chirurgia vitreale
La vitrectomia è una tecnica chirurgica con molte indicazioni che spaziano dal distacco di retina alla retinopatia diabetica, alla chirurgia maculare per un totale di decine di migliaia di interventi l’anno soltanto in Italia.
La gestione della pressione oculare in corso di vitrectomia è un argomento di particolare delicatezza, e danni al nervo ottico sotto forma di difetti del campo visivo sono stati descritti fino al 14% di tutti casi (1) mentre più raramente si possono verificare evenienze ancora più gravi quali edema del disco ottico, ipotonia, calo del visus (2).
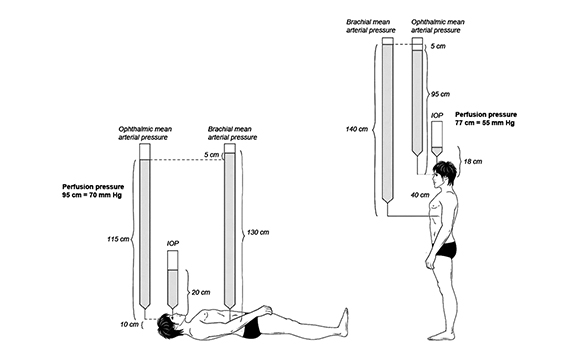
Tra i meccanismi patogenetici ipotizzati, la combinazione di un’alterazione delle pressione oculare combinata a una ridotta perfusione del nervo ottico in corso di chirurgia, è oggi ritenuto il più plausibile (4-16). L’occhio è infatti un distretto corporeo pressurizzato e affinché il sangue possa perfondere appropriatamente il nervo ottico, la retina e tutti i tessuti oculari, è necessario che la pressione dell’arteria oftalmica sia almeno in grado di “vincere” la pressione idrostatica presente all’interno del bulbo (fig. 1).
Le condizioni che determinano una pericolosa riduzione della pressione di perfusione arteriosa e possono causare danno del nervo ottico sono dovute al calo della pressione arteriosa o all’incremento di quella oculare o, più spesso, a una combinazione delle due (11).
Nel corso della vitrectomia, che può durare dai 30 minuti a più di 2 ore, la pressione oculare viene imposta dal chirurgo in funzione dell’altezza della boccia di infusione (o della sua pressione idrostatica), al fine di rimpiazzare il volume estratto dal vitrectomo, evitando il collasso del bulbo. La pressione viene mediamente settata intorno ai 35 mmHg per tutto il tempo della chirurgia con picchi pressori anche marcati nel caso vengano iniettati fluidi come il perfluorocarbonato, una manovra che può far innalzare la pressione oculare acutamente oltre i 100 mmHg.
Come si calcola la pressione dell’arteria oftalmica e la pressione di perfusione oculare?
La pressione di perfusione dell’arteria oftalmica (MAP = Mean Arterial Pressure) in un paziente supino può essere calcolata conoscendo la pressione arteriosa sistolica e diastolica omerale e la pressione oculare secondo più formule proposte in letteratura. La più spesso utilizzata (17-20) calcola la pressione arteriosa media, quella dell’arteria oftalmica e quella di perfusione (fig. 2) secondo il metodo:

Pressione arteriosa media
MAP = 2/3 DBP + 1/3 SBP
Dove
DBP = Diastolic Blood Pressure
SBP = Systolic Blood Pressure
Pressione media dell’arteria oftalmica in paziente supino
Mean Ophthalmic Artery Pressure
(MOAP) 21 22
MOAP = (115/130) MAP
E infine
Mean Ophthalmic Perfusion Pressure (MOPP)
MOPP = MOAP – IOP
Quindi, conoscendo la pressione arteriosa sistolica e diastolica e la pressione intraoculare, è possibile calcolare quanto è perfuso il nervo ottico.
Nella letteratura scientifica vengono ritenuti sicuri e pertanto auspicabili valori di pressione di perfusione dell’arteria oftalmica superiori ai 30 mmHg e ideali quelli intorno ai 50 mmHg.
Si tratta di un dato di fondamentale importanza nel corso di tutte le chirurgie, in particolar modo quelle più lunghe, fino a oggi completamente ignorato. A tutt’oggi, infatti, la pressione oculare viene gestita innalzando la pressione della boccia di infusione, dato che non tiene conto della pressione arteriosa che quel dato paziente ha in quel preciso istante.
Facciamo qualche esempio: se un paziente ha una pressione arteriosa nella norma, diciamo 130/80, e la boccia di infusione viene tenuta a 35 mmHg, allora la sua pressione arteriosa media (MAP) sarà 96,9 mmHg, la pressione media dell’arteria oftalmica (MOAP) sarà 85,5 mmHg e sottraendo da quest’ultima la pressione oculare si otterrà la pressione di perfusione oculare (MOPP) pari a (85,5-35) = 50,5 mmHg, un valore ottimale.
Se però lo stesso paziente è stato sedato in quanto ansioso e la sua pressione arteriosa si è abbassata a 90/60 mmHg, valori facilmente raggiunti nelle sedazioni profonde e ancor più facilmente nelle narcosi, allora a parità di altezza della boccia a 35 mmHg, la pressione arteriosa media (MAP) sarà 70 mmHg, quella dell’arteria oftalmica (MOAP) 61,9 mmHg e quella di perfusione oculare (MOPP) 26,9 mmHg, un valore francamente pericoloso per lo stato di salute del nervo ottico e che non può essere tollerato a lungo.
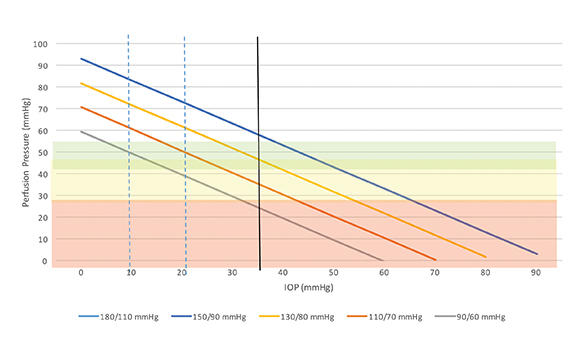
La figura 3 riporta un nomogramma con le aree di perfusione pericolose (< 30 mmHg), dubbie (tra 30 e 45 mmHg) e ritenute sicure (>45 mmHg) rispettivamente in rosso, giallo e verde. Appare evidente come una boccia di infusione posizionata ad un’altezza pari a 35 mmHg determini perfusioni dell’arteria oftalmica completamente differenti, da pericolose a perfettamente normali, in funzione della pressione arteriosa del medesimo paziente.
Ne risulta che il solo controllo della pressione o dell’altezza della boccia di infusione è puramente finalizzato ad evitare il collasso del bulbo oculare ma non dà alcuna garanzia di sicurezza e di adeguata perfusione del bulbo oculare in corso di vitrectomia.
Case report
Viene di seguito esposto il grafico di pressione oculare, arteriosa e di perfusione dell’arteria oftalmica, misurati in tempo reale con sensore di pressione al cannello di infusione a scopo sperimentale per dimostrare quanto l’andamento della pressione oculare e di conseguenza della perfusione dell’arteria oftalmica sia erratico e spesso pericoloso in corso di una reale chirurgia combinata di facoemulsificazione e vitrectomia per pucker maculare (23) (fig. 4).
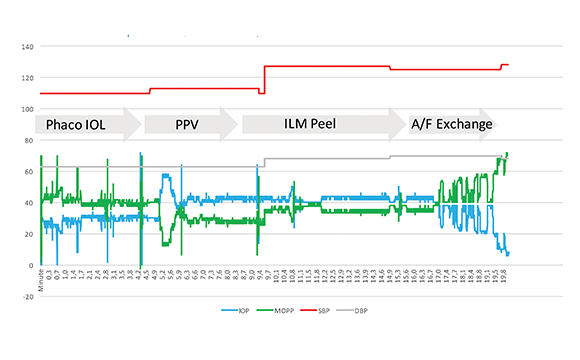
Si noti come nel corso di questo intervento combinato di vitrectomia e facoemulsificazione, la pressione oculare abbia dei picchi istantanei fino intorno ai 80 mmHg, cui corrispondono pressioni di perfusione dell’arteria oftalmica molto al di sotto della norma. Il grafico di riepilogo dei valori pressori nel corso di tutta la chirurgia riportato in alto a destra nella figura, mostra come persino in una chirurgia perfettamente priva di inconvenienti come quella riportata, la pressione di perfusione sia al di sotto dei valori ritenuti fisiologici per il 22% dell’intera chirurgia, pari a un quinto della durata totale.
Per una chirurgia più sicura
Come abbiamo appena osservato, la pressione oculare che pure è il solo parametro fino ad oggi tenuto in considerazione dal chirurgo, non è certamente l’unico e sicuramente non è il più importante nella gestione della perfusione del nervo ottico e della retina, vero motivo per il quale si modifica la pressione oculare nel corso di una chirurgia.
Per ovviare a questa lacuna e oggettiva fonte di pericolo nel corso di chirurgie lunghe e complesse quali la vitrectomia, abbiamo sviluppato e brevettato in collaborazione con Optikon 2000 un sistema capace di valutare in tempo reale la pressione di perfusione oculare, segnalarlo al chirurgo e anche controllare autonomamente la pressione della boccia di infusione in funzione della pressione arteriosa di quel paziente in quel preciso istante (23).
I vantaggi sono molteplici e di grande peso clinico: un sistema capace di misurare in tempo reale la perfusione del nervo ottico e regolare di conseguenza la pressione oculare oltre ad avvertire il chirurgo è un sistema che si prende cura del reale problema: garantire continuamente un adeguato flusso sanguigno al nervo ottico.
Questo permette al chirurgo di operare con maggiore tranquillità sapendo che la macchina sceglie continuamente la pressione oculare adatta alle condizioni circolatorie di quel paziente.
Il vitrectomo (R-Evolution CR 800 Optikon 2000 SpA, Roma) possiede un bracciale per la misura autonoma della pressione arteriosa del paziente che comunica wireless con la consolle del vitrectomo, acquisendo i dati di pressione sistolica e diastolica ad intervalli scelti dal chirurgo (23). La pressione della boccia di infusione è ovviamente nota al sistema di vitrectomia che calcola in tempo reale la pressione di perfusione dell’arteria oftalmica di quel preciso istante mostrandola al chirurgo. Il chirurgo può così decidere di variare la pressione dell’infusione del vitrectomo sulla scorta delle informazioni ricevute o lasciare che sia la macchina ad gestire autonomamente la pressione di perfusione, contro-reazionando la boccia di infusione in base alla pressione misurata al paziente.
La macchina possiede un software proprietario e un sistema brevettato che mostra se i valori attualmente calcolati sono sicuri, al fine di informare il chirurgo in tempo reale e permettergli di decidere se intervenire sulla pressione di infusione. Il sistema può tuttavia fare di più: può sollevare il chirurgo dall’onere di controllare quanto sia perfuso il nervo ottico, assumendo la macchina stessa il controllo della pressione di infusione in funzione della pressione di perfusione che può essere mantenuta costante.
Il chirurgo può decidere di porre come condizione fissa una certa pressione di perfusione dell’arteria oftalmica, diciamo 45 mmHg, e di conseguenza il sistema calcolerà la pressione di infusione (=altezza della boccia) in rapporto alla pressione arteriosa continuamente monitorata.
Nel futuro quindi (o meglio già oggi) non imposteremo la pressione di infusione a 30 mmHg (succeda quel che succeda…), ma delegheremo la macchina a garantirci una sicura pressione di perfusione dell’arteria oftalmica. Sarà il R-Evolution a gestire l’altezza della boccia in funzione della pressione arteriosa del paziente, garantendo sempre una pressione personalizzata e sicura per quel paziente in quel preciso istante durante tutte le fasi dell’intervento; una vera e propria personalizzazione della pressione continuamente aggiustata sui bisogni del paziente.
Si tratta di una svolta importante nei sistemi di gestione della pressione che per la prima volta non si fermano su valori rigidamente imposti ma si adattano con logica “fuzzy” all’andamento della pressione arteriosa del paziente.
Bibliografia
- Cazabon S, Groenewald C, Pearce IA, Wong D. Visual loss following removal of intraocular silicone oil. Br J Ophthalmol 2005 July;89(7):799-802.
- Hayreh SS. Posterior ischaemic optic neuropathy: clinical features, pathogenesis, and management. Eye (Lond) 2004 Nov;18(11):1188-206.
- Taban M, Lewis H, Lee MS. Nonarteritic anterior ischemic optic neuropathy and ‘visual field defects’ following vitrectomy: could they be related? Graefes Arch Clin Exp Ophthalmol 2007 Apr;245(4):600-5. Epub 2006 Oct 6.
- McCulley TJ, Lam BL, Feuer WJ. Incidence of nonarteritic anterior ischemic optic neuropathy associated with cataract extraction. Ophthalmology 2001 Jul;108(7):1275-8.
- Tsagkataki M, Rowlands A. Visual Loss due to non-arteritic anterior ischemic optic neuropathy (NAION) immediately following routine strabismus surgery under general anesthesia-a case report. Strabismus 2012 Sep;20(3):121-3. doi: 10.3109/09273972.2012.702327.
- Bansal AS, Hsu J, Garg SJ, Sivalingam A, Vander JF, Moster M, Maguire JI, Regillo CD. Optic neuropathy after vitrectomy for retinal detachment: clinical features and analysis of risk factors. Ophthalmology 2012 Nov;119(11):2364-70. doi: 10.1016/j.ophtha.2012.06.002. Epub 2012 Jul 26.
- Gaillard MC, Zambaz BD, Borruat FX. Posterior ischemic optic neuropathy: case report of a rare complication after general surgery. Klin Monbl Augenheilkd 2004 May;221(5):421-3.
- Pandey KH, Chandrakar AK, Garg ML. Perioperative visual loss with non-ocular surgery: Case report and review of literature. Indian J Ophthalmol 2013 Sep 6. [Epub ahead of print]
- Abdal H, Pizzimenti JJ, Purvis CC. The eye in sleep apnea syndrome. Sleep Med 2006 Mar;7(2):107-15. Epub 2006 Feb 3. Review.
- Foroozan R, Buono LM, Savino PJ. Optic disc structure and shock-induced anterior ischemic optic neuropathy. Ophthalmology 2003 Feb;110(2):327-31.
- Hayreh SS. Ischemic optic neuropathies - where are we now? Graefes Arch Clin Exp Ophthalmol 2013 Aug;251(8):1873-84. doi: 10.1007/s00417-013-2399-z. Epub 2013 Jul 3.
- Chu ER, Lee AW, Chen CS. Resolution of visual field constriction with verapamil in a patient with bilateral optic neuropathy, migraine and Raynaud’s phenomenon. Intern Med J 2009 Dec;39(12):851-3. doi: 10.1111/j.1445-5994.2009.02080.x.
- Arda H, Birer S, Aksu M, Ismailogullari S, Karakucuk S, Mirza E, Gumus K, Oner A. Obstructive sleep apnoea prevalence in non-arteritic anterior ischaemic optic neuropathy. Br J Ophthalmol 2013 Feb;97(2):206-9. doi: 10.1136/bjophthalmol-2012-302598. Epub 2012 Nov 30.
- Bonomi L, Marchini G, Marraffa M, et al. Vascular risk factors for primary open angle glaucoma: the Egna-Neumarkt Study. Ophthalmology 2000;107:1287-93.
- Kuriyan AE, Lam BL. Non-arteritic anterior ischemic optic neuropathy secondary to acute primary-angle closure. Clin Ophthalmol 2013;7:1233-8. doi: 10.2147/OPTH.S45372. Epub 2013 Jul 5.
- Devoto MH, Kersten RC, Zalta AH, Kulwin DR. Optic nerve injury after retrobulbar anesthesia. Arch Ophthalmol 1997 May;115(5):687-8
- Caprioli J, Coleman AL. Blood Flow in Glaucoma Discussion. Blood pressure, perfusion pressure, and glaucoma. Am J Ophthalmol 2010;149:704-12.
- Bill A. Physiological aspects of the circulation in the optic nerve. In: Heilmann K, Richardson KT editor. Glaucoma: Conceptions of a Disease. Philadelphia, WB: Saunders; 1978. p. 97-103.
- Choi J, Jeong J, Cho H-S, Kook Effect of nocturnal blood pressure reduction on circadian fluctuation of mean ocular perfusion pressure: a risk factor for normal tension glaucoma. Invest Ophthalmol Vis Sci 2011;47:831-6.
- Hayreh SS. Blood flow in the optic nerve head and factors that may influence it. Prog Retin Eye Res 2001;20:595-624.
- Liu JHK, Gokhale PA, Loving RT, et al. Laboratory assessment of diurnal and nocturnal ocular perfusion pressures in humans. J Ocul Pharmacol Ther 2003;19:291-7.
- Quaranta L, Katsanos A, Russo A, Riva I. 24-hour intraocular pressure and ocular perfusion pressure in glaucoma. Surv Ophthalmol. 2013 Jan-Feb;58(1):26-41. doi: 10.1016/j.survophthal.2012.05.003. Review
- Rossi T, Querzoli G, Angelini G, Rossi A, Malvasi C, Iossa M, Ripandelli G. Ocular perfusion pressure during pars plana vitrectomy: a pilot study. Invest Ophthalmol Vis Sci 2014 Dec 2;55(12):8497-505. doi: 10.1167/iovs.14-14493.