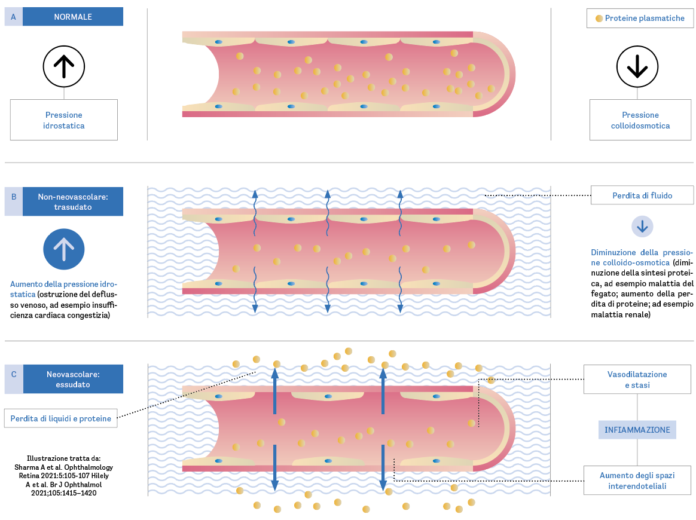
Nel corso degli anni, la presenza di fluido retinico è stata interpretata come indicatore di attività della membrana neovascolare nei pazienti affetti da degenerazione maculare legata all'età (DMLE). In passato, la rilevazione di tale fluido serviva anche da guida al trattamento intravitreale, particolarmente durante l'applicazione di regimi reattivi come il pro-re-nata (PRN). Ancora oggi, con l'avvento dei regimi treat and extend (TAE), il fluido retinico continua a conservare una posizione centrale nella scelta da parte del clinico degli intervalli di trattamento. Tuttavia, è cruciale comprendere che la presenza di fluido non è sempre indicativa di attività neovascolare. Il fluido può accumularsi nella retina attraverso due meccanismi distinti: essudazione e trasudazione. Tradizionalmente, l'accumulo essudativo è associato alla DMLE neovascolare ed è il meccanismo predominante. Tuttavia, esistono situazioni in cui il fluido trasuda attraverso un endotelio vascolare retinico intatto, in assenza di neovascolarizzazione. Questi scenari, in cui il fluido è il risultato di trasudazione in assenza di neovascolarizzazione, sono categorizzati come fluido non neovascolare. Questa distinzione è vitale per una gestione accurata dei pazienti con DMLE e per l'indirizzamento tempestivo al trattamento delle sole forme neovascolari (figura 1) (1).
Il fluido non neovascolare può accumularsi sia all'interno che al di sotto della retina neurosensoriale. Tra gli esempi di fluido non neovascolare intraretinico, si annoverano le microcisti e le pseudocisti degenerative. Diversi anni fa, Cohen et al. descrissero microcisti o pseudocisti degenerative, manifestandosi come aree iporeflettenti intraretiniche alla tomografia a coerenza ottica (OCT) (2). È cruciale evidenziare che queste pseudocisti si formano in aree di atrofia dell'epitelio pigmentato retinico e della retina esterna. In effetti, secondo gli autori, queste pseudocisti rappresentano uno stadio intermedio del processo atrofico retinico che interessa la regione maculare (figura 2).
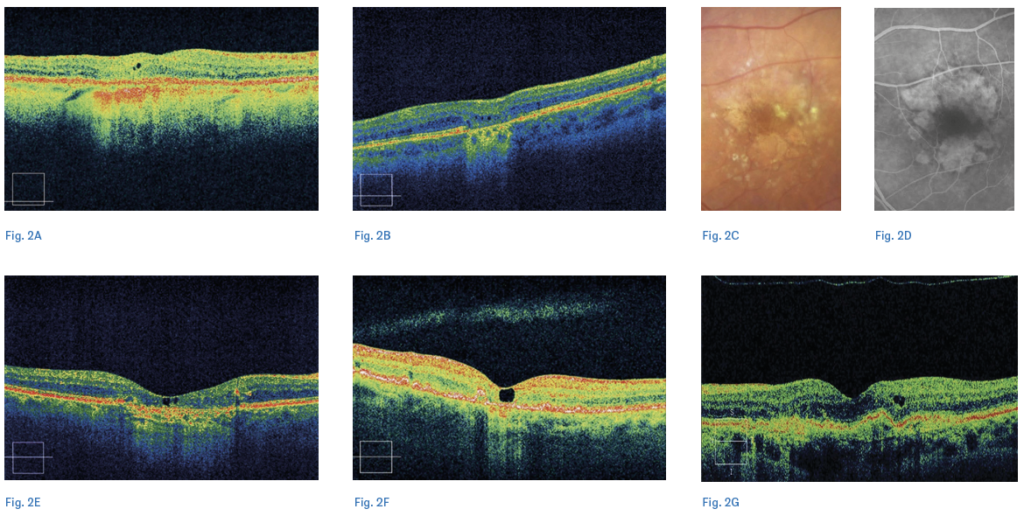
Questo stadio è caratterizzato dalla perdita progressiva delle cellule di Müller, che, come noto, giocano un ruolo significativo nel riassorbimento del fluido retinico. Pertanto, è plausibile che l'accumulo di trasudato intraretinico sia un fenomeno dovuto a un mancato riassorbimento del fluido da parte delle cellule di Müller, che degenerano gradualmente prima del completo assottigliamento della retina neurosensoriale (3). Il fluido non neovascolare intraretinico non deve essere confuso con le tubulazioni. Le tubulazioni retiniche esterne si manifestano nelle scansioni tradizionali dell’OCT come aree iporeflettenti di forma ovalare circondate da un bordo iperriflettente (4). Le tubulazioni, quindi, non sono fluido, ma rappresentano una riorganizzazione dello strato dei fotorecettori nelle forme più avanzate di DMLE. Per distinguerle efficacemente dal fluido, è essenziale analizzare le immagini en face all’OCT, che offrono una visione più completa dei pattern ramificati tipici delle tubulazioni (figura 3).
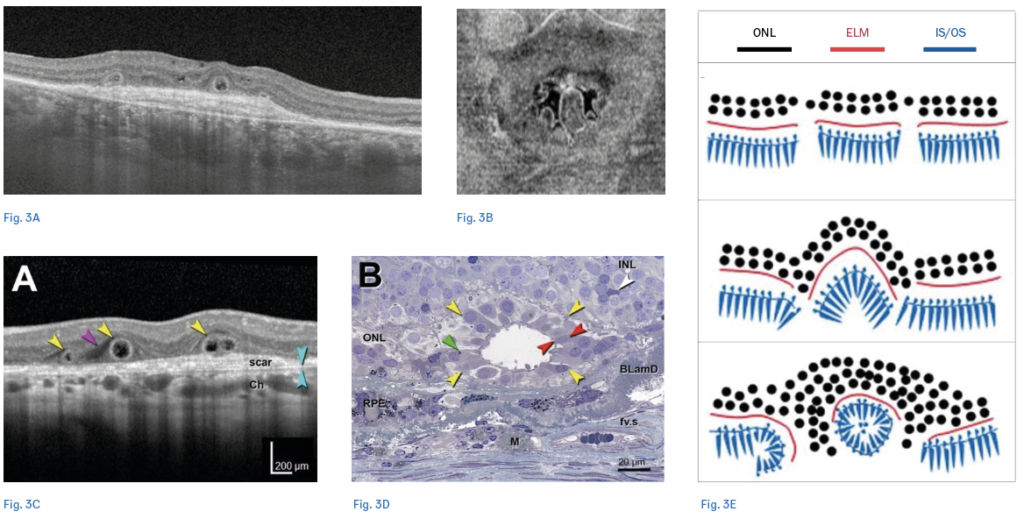
Il fluido non neovascolare può anche localizzarsi al di sotto della retina neurosensoriale. Nel 2018, Lek et al. hanno coniato il termine "distacco non essudativo della retina neurosensoriale" (NEDNR) per descrivere la presenza di fluido sottoretinico nei pazienti con AMD intermedia, in assenza di segni di neovascolarizzazione. Mediante una serie osservazionale prospettica, l'autore e il suo team hanno monitorato pazienti con drusen bilaterali >125 µm, utilizzando imaging multimodale semestrale. Nel corso di un follow-up di 30-54 mesi, hanno identificato 11 occhi di 12 pazienti con fluido sottoretinico in assenza di neovascolarizzazione coroidea all’immagine multimodale comprensiva di fluorangiografia retinica, angiografia con verde d’indocianina, SD-OCT e angiografia OCT. Questi risultati sottolineano l'importanza di identificare e a categorizzare un particolare fenotipo di DMLE che necessita di ulteriore monitoraggio al fine di determinare se e quando potrebbe essere necessario un trattamento (5).
Recentemente, Hilely e colleghi hanno investigato i pattern del SRF non neovascolare in occhi afflitti da DMLE, analizzando gli esiti a lungo termine. Hanno condotto uno studio retrospettivo includendo 45 occhi (appartenenti a 45 pazienti) affetti da AMD e fluido sottoretinico non neovascolare associato, monitorati mediante immagini OCT per una durata media di 49.7±36.7 mesi. Hanno identificato tre localizzazioni predominanti di fluido sottoretinico: una colonna di fluido sopra l'apice del PED drusenoide, una sacca di fluido vicino a grandi drusen, o una cortina di fluido tra drusen confluenti (figura 4).
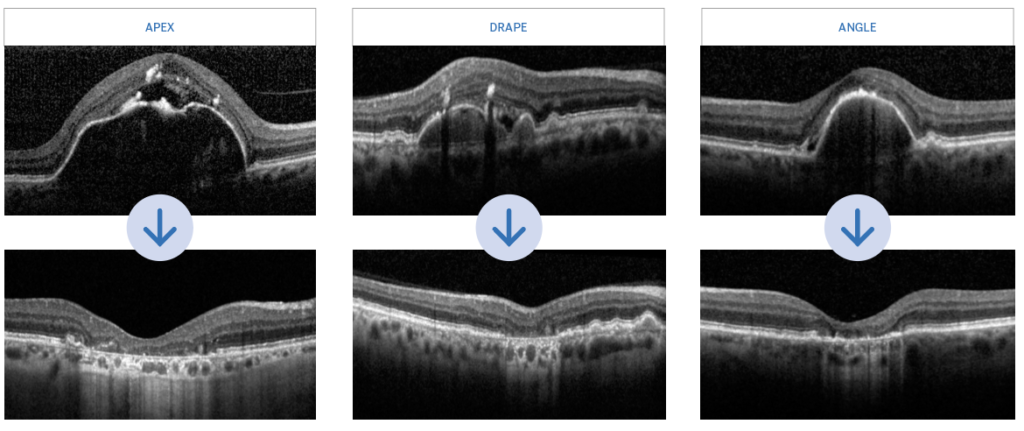
Esempi di modelli di accumulo di fluido sottoretinico non neovascolare nella DMLE.
Sono stati inclusi quarantacinque occhi. La durata media del follow-up è stata di 49,7 ± 36,7 mesi.
Ventisette occhi (60%) hanno mostrato collasso della drusa o drusenoide PED associata e 24 occhi (53%) hanno sviluppato evidenza di atrofia retinica.
Hilely A et al. Br J Ophthalmol 2021;105:1415–1420
Al termine del follow-up, 27 (60%) dei 45 occhi con accumulo di fluido hanno mostrato un collasso completo del PED drusenoide, e 24 occhi (53%) evidenziavano segni di atrofia completa o parziale dell'epitelio pigmentato retinico e della retina esterna. Gli autori hanno pertanto concluso che il fluido sottoretinico non neovascolare è una condizione clinica significativa da riconoscere per evitare terapie anti-VEGF non necessarie (6). Lo studio in questione indica inoltre che l'origine del fluido in esame deriva dalla creazione di uno spazio di separazione tra la coriocapillare e l’epitelio pigmentato retinico, un evento che si manifesta nei DEP drusenoidi o alla presenza di drusen di grandi dimensioni. Tale separazione ostacola l'apporto di ossigeno all'epitelio pigmentato retinico, provocando un disfunzionamento delle proteine di trasporto presenti, e di conseguenza, l'accumulo di fluido nello spazio sottoretinico. È evidente che la ridotta fornitura di ossigeno alla retina provoca anche una sovraespressione del fattore di crescita vascolare (VEGF) e la formazione di fluido di origine neovascolare attraverso meccanismi essudativi. Quindi, nella pratica clinica quotidiana, è possibile che una combinazione di entrambi i meccanismi (essudativi e trasudativi) possa coesistere nei pazienti con DMLE neovascolare che presentano fluido persistente (6,7).
Il fluido non neovascolare non sembra beneficiare delle terapie con farmaci anti-VEGF, tendendo a mantenersi stabile e a non progredire nel tempo. Questa constatazione è corroborata da uno studio condotto da Santina e colleghi, che ha esplorato l'evoluzione del fluido non-neovascolare nella DMLE sia dopo terapia anti-VEGF sia nel corso di un periodo di osservazione in assenza di terapia intravitreale. I risultati hanno evidenziato che, durante il periodo di follow-up senza iniezioni, lo spessore del fluido subretinico rimaneva stabile e invariato in tutti gli occhi, sia in quelli precedentemente sottoposti a terapia anti-VEGF sia in quelli mai trattati con iniezioni. Gli autori suggeriscano che un regime di osservazione ed estensione potrebbe essere considerato in occhi con AMD con fluido non-neovascolare (8).
In conclusione, il fluido non è sempre indice di attività neovascolare nei pazienti affetti da DMLE. Le cellule di Muller e le cellule dell'epitelio pigmentato retinico rappresentano elementi cruciali del percorso idrostatico nella retina, e una loro disfunzione può condurre ad accumulo di fluido in assenza di neovascolarizzazione maculare. L’angiografia OCT si rivela fondamentale per differenziare la DMLE non neovascolare da quella neovascolare, evitando così l'adozione di terapie anti-VEGF non necessarie. In particolare, l'analisi del fluido retinico e subretinico attraverso l’angiografia OCT permette una valutazione precisa della condizione retinica, prevenendo l'impiego inappropriato di trattamenti anti-VEGF che, come evidenziato da studi recenti, non risultano efficaci nel contrastare il fluido non neovascolare. Questa distinzione è cruciale nella pratica clinica quotidiana per garantire un approccio terapeutico mirato ed efficace, minimizzando al contempo l'esposizione del paziente a terapie invasive e costose non necessarie.
L’autore dichiara l’assenza di conflitti di interesse.
BiBliografia
- Sharma A, Kumar N, Parachuri N, et al. Ophthalmology Retina 2021:5:105-107. doi: 10.1016/j.oret.2020.09.016
- Cohen SY, Dubois L, Nghiem-Buffet S, et al. Am J Opthalmol 2010;150(2):211-217.e1. doi: 10.1016/j.ajo.2010.02.019
- Reichenbach. A, Wurm A, Pannicke Tet al. Graefe’s Arch Clin Exp Ophthalmol (2007) 245: 627-636 doi: 10.1007/s00417-006-0516-y
- Zweifel SA, Engelbert M, Laud K et al. Arch Ophthalmic 2009 Dec;127(12):1596-602
- Lek JJ, Caruso E, Baglin E et al. Ophthalmol Retina 2018;2(8):792-802. doi: 10.1016/ j.oret.2018.01.005.
- Hilely A, Au A, Freund KB et al. Br J Ophthalmol 2021;105(10):1415-1420. doi: 10.1136/bjophthalmol-2020-317326.
- Marmor MR. Doc Ophthalmol 1999;97(3-4):239-49. doi: 10.1023/a:1002192829817
- Santina A, Romero-Morales V, Abraham N et al. Can J Ophthalmol 2022; 13:S0008-4182(22)00251-4. doi: 10.1016/j.jcjo.2022.08.005