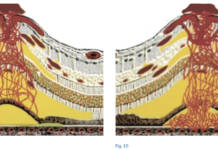
La miopia è un disordine rifrattivo nel quale le immagini vengono focalizzate davanti alla retina.
La miopia può essere assile quando è il risultato dell’allungamento del bulbo oculare che avviene nel corso dell’infanzia e dell’adolescenza oppure rifrattiva quando la causa è l’aumento del potere rifrattivo del diottro oculare per sclerosi nucleare del cristallino o aumento delle curvature corneali come nel cheratocono.
I dati epidemiologici recenti mostrano come la miopia sia una condizione patologica “drammaticamente” in aumento nella popolazione mondiale soprattutto in età giovanile.
Colpisce l’80-90% della popolazione giovanile (con età compresa tra 17 e 18 anni) nei paesi dell’Asia orientale (quali Singapore, Taiwan ed in Giappone) dove il 20-30% della popolazione miope riguarda bambini di età tra 6-7 anni (1).
Nei paesi occidentali la prevalenza della miopia è in crescita soprattutto nella popolazione sotto i 25 anni, fascia d'età in cui colpisce il 46% dei soggetti, mentre tale percentuale scende al 15% nella popolazione con età superiore ai 75 anni. Dati recenti riferiscono come la miopia pediatrica risulti essere una condizione di salute pubblica che riguarda il 22.9% della popolazione mondiale (2).
Le stime attuali di progressione prevedono che la miopia elevata (con difetto rifrattivo maggiore di 6D) che interessava circa 1406 milioni di persone nel mondo nel 2000 aumenterà a circa 1 miliardo nel 2050.
Questa previsione epidemiologica purtroppo evidenzia quello che viene chiamato "adattamento darwiniano" delle nuove generazioni, termine che ben descrive come i cambiamenti nel “lifestyle” delle nuove generazioni, che utilizzano in maniera fin troppo estesa i device elettronici quali PC, tablet e cellulare, possano influenzare la struttura oculare e favorire la progressione della miopia (2).
Tale adattamento sembrerebbe non interessare solo alcune etnie, soprattutto asiatiche, ma appare colpire ogni razza: nel “The Gutenberg Eye Study”, pubblicato in Gran Bretagna nel 2014, viene evidenziato come la prevalenza della miopia negli studenti asiatici risulta essere del 53.4% e del tutto simile a quella presente nelle popolazioni di giovani caucasici dove è risultata interessare il 50% di questi (3).
Tipi di miopia
La miopia si divide in congenita, quindi già presente alla nascita, semplice, caratterizzata dalla sola presenza del difetto rifrattivo e dalla sua benignità, e degenerativa, con caratteristiche evolutive che possono arrivare a compromettere la visione a causa di alterazioni retiniche tipiche. Inoltre si può classificare in lieve, moderata e grave a seconda dell’entità. Le miopie gravi sono quelle sopra le 7-8 diottrie e che sono gravate da alterazioni retiniche.
Gli studi epidemiologici, effettuati soprattutto sulla popolazione asiatica, riportano come la miopia degenerativa sia tra le cause più frequenti di ipovisione e/o cecità nella popolazione dopo i 50 anni di età, seconda solo alla cataratta. Il progressivo allungamento del bulbo oculare nella miopia elevata degenerativa causerebbe lo stiramento dei tessuti: la sclera nella regione peripapillare, la coroide e la retina.
La conseguenza di questo è la comparsa di alcune complicanze quali l’atrofia corio-retinica peripapillare ed il glaucoma, disturbi presenti nel 17% dei miopi elevati, l’atrofia corio-retinica maculare con neovascolarizzazione coroideale nel 39% e il distacco di retina regmatogeno, il foro maculare e la sindrome da trazione vitreo maculare nel 15% (4).
Eziopatogenesi
Dal punto di vista eziopatogenetico, la teoria di sviluppo della miopia più accreditata attribuisce la progressione ad una interazione complessa tra predisposizione genetica ed ambiente (gene-environment).
Sono 18 i loci genetici (MY2,MY3, My5) che appaiono coinvolti nella crescita del globo oculare e risultano espressi ubiquitariamente nella sclera, nella coroide e nella retina. Questi geni sono strettamente coinvolti nella via metabolica del TGF-beta/BMPs e sembrerebbe che la riduzione dell’espressione delle isoforme del TGF-beta nella sclera comporterebbe una riduzione nella sintesi di collagene con conseguente predisposizione all’allungamento del globo oculare.
Altri geni sarebbero coinvolti nella sintesi del collagene (LERPEL1), nel metabolismo ATP retinico (SCO2), nella trascrizione di fattori (ZNF644) e nella degradazione di proteine lisosomiali (CTSH) con conseguente tendenza della sclera ad esser più estensibile e così favorire l’allungamento bulbare e la progressione della miopia (5).
Il rischio genetico è associato al polimorfismo di un singolo nucleotide in geni correlati alla miopia: più alleli di tali “geni di rischio miopico” sono presenti, maggiore è l’associazione con la miopia elevata (6). Tale rischio diventa ancora più alto se i soggetti portatori sono esposti a fattori ambientali ritenuti fortemente associati alla progressione della miopia, come l’applicazione visiva intensa da vicino (near work activity) richiesta in un percorso educativo elevato, ad esempio quello universitario, e la minor esposizione ad attività all’aperto (oudoor activities) (7).
Tra i fattori ambientali l’attività all’aria aperta sembrerebbe esser quella con maggior influenza nel rischio di sviluppo della miopia con una riduzione del 23% dell’incidenza della stessa nei soggetti che passano un numero maggiore di ore all’esterno (8). Tale minor rischio sarebbe correlato al ruolo della luce solare sui livelli di dopamina nella retina e tale da prevenire l’eccessivo allungamento del bulbo oculare (9). Gli studi recenti considerano l’effetto protettivo della luce solare maggiore nel ridurre l’"onset" della miopia piuttosto che nella progressione della patologia (10).
Sebbene l’attività prolungata da vicino (near work activity), come ad esempio quella conseguente all’uso di cellulari e palmari in età infantile, sembrerebbe fortemente correlata con la progressione della miopia, alcuni studi recenti non mostrano un effetto statisticamente significativo (11).
Tra i fattori ambientali l’attività all’aria aperta sembrerebbe esser quella con maggior influenza nel rischio di sviluppo della miopia con una riduzione del 23% dell’incidenza della stessa nei soggetti che passano un numero maggiore di ore
 Patogenesi
Patogenesi
La patogenesi ed i meccanismi biologici della miopia sono stati oggetto di indagine e discussione. Le teorie attuali volgono l’attenzione su alcuni meccanismi principali:
la compensazione dell’hyperopic defocus della retina periferica correlato al “relative refractive refraction”.
In presenza di miopia, anche rifrattivamente corretta, esiste una sfocatura provocata dalla ipermetropia relativa periferica del diottro oculare miope che stimola l’allungamento del bulbo e la progressione della miopia.
Di conseguenza avvengono alcuni sovvertimenti anatomici dei tessuti come ad esempio la coroide che può modificare il suo spessore per avvicinare la retina al piano focale (12).
Il ruolo della dopamina, liberata dalle cellule amacrine della retina in risposta allo stimolo luminoso, riduce il livello di metalloprotinasi ed ha così un ruolo protettivo sullo sviluppo della miopia (1).
La dopamina è un neurotrasmettitore retinico che è coinvolto nella cascata di segnali che inducono la crescita bulbare indotta dalla visione.
L’effetto protettivo sulla progressione miopica della luce solare e del ritmo circadiano di secrezione della melatonina sembrerebbero esser mediati dalla produzione e dal rilascio di dopamina a livello retinico (9). Infatti, i livelli di melatonina sierici sono molto più alti nei miopi (13).
L’ipossia sclerale indotta da alcuni stimoli visivi innescherebbe una cascata di segnali che comportano la trans-differenziazione dei mio fibroblasti sclerali e della matrice extracellulare con modificazione della struttura della sclera e l’induzione della progressione miopica (14).
Trattamenti
Focalizzando l’attenzione sui meccanismi biologici e fisiopatologici correlati con lo sviluppo e la progressione, nel corso degli anni sono stati tentati alcuni trattamenti per ridurre la miopia e la sua evoluzione. Tali trattamenti sono stati oggetto di revisione da parte della letteratura scientifica (15, 16).
L’ipocorrezione del difetto rifrattivo. Lo scopo è indurre un defocus miopico per inibire l’allungamento del bulbo. La revisione della letteratura scientifica a riguardo ha evidenziato come tale espediente non abbia alcun effetto statisticamente significativo ed anzi sembrerebbe responsabile della progressione della miopia.
La raccomandazione clinica è di evitare la modifica frequente del potere dell’occhiale capace di indurre uno stimolo all’evoluzione miopica oltre che di disturbi astenopeici.
L’uso di occhiali con lenti bifocali e multifocali. Il meccanismo supposto sarebbe quello di ridurre lo sforzo accomodativo durante il lavoro da vicino ed il defocus ipermetropico periferico della retina.
Recenti studi attribuirebbero a tali occhiali un effetto limitato nel tempo ed una riduzione media della miopia inferiore a 0.16D all’anno, effetto giudicato clinicamente non significativo. Recentemente è stato introdotto l’uso di occhiali con lenti ad effetto sul defocus periferico allo scopo di ridurre l’ipermetropia periferica relativa (17).
Purtroppo tali occhiali speciali non hanno mostrato risultati statisticamente significativi nel ridurre l’aumento della lunghezza assiale e l’equivalente sferico. Effetti così poco convincenti sono stati attribuiti ai costi elevati ed alle difficoltà di costruzione e di mantenimento della posizione del defocus periferico da parte di un occhiale a tempiale indossato dai piccoli pazienti (15,16,18).
L’uso di lenti a contatto. Nel corso degli anni molti autori hanno sperimentato l’effetto di differenti tipologie di lenti a contatto corneali, da quelle morbide a quelle rigide. La revisione della letteratura esistente ha chiaramente mostrato come tali ausili non abbiano alcun effetto sulla progressione della miopia.
Recentemente sono state introdotte lenti a contatto morbide con effetto di defocus (Defocus Incorporated Soft Contact Lens o DISCL) e lenti a contatto bifocali con aberrazione sferica positiva (Bifocal SCL). Le lenti DISCL presentano zone concentriche con l’alternanza di una correzione rifrattiva completa per distanza ad aree di defocus miopico.
L’effetto del defocus periferico modificato delle lenti DISCL sembra esser promettente, sebbene tali applicazioni non abbiano finora follow-up convincenti (19).
Una menzione a parte merita l’uso di lenti a contatto rigide e con geometria modificata per appiattire la curvatura corneale durante il riposo notturno o ortocheratologia.
Il meccanismo d’azione di tali ausili non è stato completamente chiarito: l’effetto supposto sarebbe indotto dal rimodellamento del centro della cornea e dalla conseguente riduzione dello sfocamento ipermetropico periferico relativo.
La maggior parte degli studi che utilizzano tale terapia mostrano in 2 anni una riduzione media dell’allungamento assiale del bulbo di 0.29-0.19mm che, se confrontata con quella ottenuta con l’uso di semplici occhiali pari a 0.63-0.51mm, appare particolarmente significativa e con una riduzione media del difetto rifrattivo in equivalente sferico di 2.09 ± 1.34 D (20).
La revisione della letteratura ha evidenziato come tali risultati non possono esser considerati significativi a causa dell’attuale persistente assenza di trial clinici randomizzati e del breve follow-up presente nella maggior parte degli studi ed inferiore ai 3 anni, tempo giudicato assolutamente non sufficiente per considerare valido il risultato nella progressione miopica.
Inoltre la revisione della letteratura ha sottolineato l’esistenza di un effetto di “myopia rebound” alla sospensione delle lenti corneali (21, 22) con rischio di maggiore e più rapida progressione dopo soli 3 mesi di sospensione (21). Poiché tale terapia si basa sull’uso esteso di lenti a contatto in bambini e giovani, è d’obbligo considerare che tale applicazione sia minata dalle difficoltà di costruzione e la bassa compliance nei bambini in cui la presenza di allergie e la atopia può renderne l’uso ancora più complicato.
Inoltre sono sempre più numerosi i report che denunciano il rischio elevato di cheratiti infettive con il rinvenimento nel 69.7% di contaminazione microbica della lente corneale e dei contenitori di conservazione, in particolar modo da parte di germi Meticillino-resistenti (MRSA), Pseudomonas aeruginosa e Acanthameba. Un dato che risulta particolarmente allarmante è la necessità di sottoporsi ad una cheratoplastica terapeutica nel 20.2% dei soggetti che praticano tale terapia (23, 24).
Infatti, una delle cause principali di interruzione dell’uso di lenti per ortocheratologia è proprio la comparsa di infezioni corneali entro 2 anni dall’applicazione (16).

Terapie farmacologiche
L’introduzione di trattamenti farmacologici a base di antagonisti muscarinici quali l’atropina è stata particolarmente attenzionata dai ricercatori.
L’atropina è un antagonista non selettivo dei recettori muscarinici ed il suo effetto nella prevenzione della miopia non è stato ancora completamente compreso.
I meccanismi d’azione dell’atropina più accreditati sono: a) il ruolo di profarmaco nella stimolazione della produzione di dopamina a livello dell’epitelio pigmentato retinico attraverso i recettori M1/M4, con attivazione della cascata neurochimica che inibirebbe l’allungamento del bulbo; b) l’effetto positivo sull’inibizione della sintesi di glicosaminoglicani da parte dei fibroblasti sclerali (25).
La somministrazione topica di atropina si è dimostrata la terapia più efficace e duratura per rallentare la miopia con percentuali di successo che variano tra il 56 ed il 96% ed una riduzione media annuale dell’equivalente sferico che va da 0.68 a 0.53D e della lunghezza assiale da -0.21 a -0.15m (16, 25, 26). Tali risultati sono dose dipendente.
Dalla sua introduzione è ancora aperto un dibattito sulla miglior concentrazione di utilizzo: sono state testate tutte le concentrazioni di atropina topica, dall’1% a dosaggi minimi dello 0.01%. Le concentrazioni più basse del 0.01% e 0.05%, alla dose di 1 goccia di somministrazione serale, sembrerebbero garantire un buon compromesso tra efficacia e riduzione degli effetti collaterali quali midriasi, abbagliamento, fotofobia e reazioni allergiche (27,28). Il reale limite è l’assenza in commercio di preparazioni a base di atropina a bassa diluizione (inferiore al 0.5%) e questo comporta il ricorso all’uso di preparati galenici con i relativi problemi di approvvigionamento, stabilità e sterilità.
Alcuni autori hanno suggerito di protrarre la somministrazione topica di atropina 0.01% per almeno 2 anni se la progressione miopica è inferiore a 0.50D in 6 mesi, mentre nel caso di progressioni maggiori è consigliabile aumentare la concentrazione dell’atropina e/o associare altre terapie (29).
Sono stati descritti effetti di “myopia rebound” alla sospensione precoce della somministrazione ma tali effetti appaiono esser dose dipendente: maggiore è la concentrazione della preparazione e il numero di somministrazioni e peggiore risulta la progressione miopica alla sospensione (16, 30).
Recentemente l’uso di un antagonista M1 selettivo dell’acetilcolina quale la pirenzepina 2% gel sembra promettente sebbene la sua applicazione sia ancora limitata a pochi trial clinici con breve follow-up (31).

In passato l’uso di farmaci ipotonizzanti oculari era stato proposto allo scopo di ridurre lo stimolo della pressione oculare su tessuti geneticamente predisposti ma tale applicazione è risultata assolutamente inefficace sulla progressione della miopia (16, 25).
Alcuni nuovi farmaci quali il salidroside e la formononetina, già utilizzati per l’effetto anti-ipossico sul muscolo cardiaco, sono stati presi in considerazione per la terapia dell’ipossia sclerale nella miopia e nel ridurre la neovascolarizzazione retinica e coroideale (25).
In conclusione, la letteratura scientifica ha attualmente ribadito come le terapie farmacologiche, soprattutto a base di atropina a basso dosaggio, siano da considerarsi le più efficaci e sicure nel ridurre l’evoluzione della miopia grazie alla validazione ottenuta attraverso studi clinici diffusi in tutto il mondo. Altre terapie quali l’ortocheratologia e le lenti con defocus periferico sembrerebbero avere un effetto più modesto, costi maggiori e la necessità di una validazione adeguata attraverso ulteriori approfondimenti (15, 16, 25, 29).
La letteratura scientifica ha attualmente ribadito come le terapie farmacologiche, soprattutto a base di atropina a basso dosaggio, siano da considerarsi le più efficaci e sicure nel ridurre l’evoluzione della miopia grazie alla validazione ottenuta attraverso studi clinici diffusi in tutto il mondo
Bibliografia
- Epidemiology of myopia. Wu PC, Huang HM, yu HJ. Asia Pac J Ophthalmol 2016; 5: 386-393.
- Global Prevalence of Myopia and High Myopia and Temporal Trends from 2000 through 2050. Holden BA, Fricke TR, Wilson DA, Jong M, Naidoo KS, Sankaridurg P, Wong TY, Naduvilath TJ, Resnikoff S. Ophthalmology. 2016 May;123(5):1036-42. doi: 10.1016/j.ophtha.2016.01.006. Epub 2016 Feb 11.PMID: 26875007
- Prevalence of refractive errors in the European adult population: the Gutenberg Health Study (GHS) Christian Wolfram, René Höhn,Ulrike Kottler,Philipp Wild, Maria Blettner,Jens Bühren, Norbert Pfeiffer, Alireza Mirshahi. l. Br J Ophthalmol 2014;98:857–861. doi:10.1136/bjophthalmol-2013-304228.
- Epidemiology of myopia and prevention of myopia progression in children in east Asia: a review. Mak CY, Yam JCS, Lee SM, Young AL. Hong Kong Med J. 2018; 24: 602-9.
- Insight into the molecular genetics of myopia. Jiali Li and Qingjiong Zhang. Mol Vis. 2017; 23: 1048–1080.
- Genome-wide meta-analyses of multiancestry cohorts identify multiple new susceptibility loci for refractive error and myopia. Virginie J M Verhoeven, Pirro G Hysi, Christopher J Hammond. Nature Genetics 2013; 45: 314–318.
- Education influences the role of genetics in myopia Virginie J. M. Verhoeven, Gabrielle H. S. Buitendijk • Consortium for Refractive Error and Myopia (CREAM) Fernando Rivadeneira, André G. Uitterlinden, Johannes R. Vingerling, Albert Hofman, Caroline C. W. Klaver. Eur J Epidemiol (2013) 28:973–980 DOI 10.1007/s10654-013-9856-1.
- Outdoor activity during class recess reduces myopia onset and progression in school children. Pei-Chang Wu , Chia-Ling Tsai, Hsiang-Lin Wu, Yi-Hsin Yang, Hsi-Kung Kuo. Ophthalmology 2013. May;120(5):1080-5.
- An updated view on the role of dopamine in myopia. Marita Feldkaemper, Frank Schaeffel . Exp Eye Res 2013; 114: 106-119.
- Prevention of Progression in Myopia: A Systematic Review. Aldo Vagge, Lorenzo Ferro Desideri, Paolo Nucci , Massimiliano Serafino, Giuseppe Giannaccare , Carlo E Traverso. Deseases 2018 Sep 30;6(4):92.
- Epidemiology of myopia and prevention of myopia progression in children in East Asia: a review Introduction Myopia. CY Mak, Jason CS Yam, LJ Chen, SM Lee, Alvin L Young. Hong Kong Med J 2018;24:602–9 DOI: 10.12809/hkmj187513.
- Local retinal regions control local eye growth and myopia. J Wallman, MD Gottlieb, V Rajaram, LA Fugate-Wentzek. Science 03 Jul 1987; 237, 4810: 73-77 DOI:10.1126/science.3603011.
- Melatonin Receptors in Chick Ocular Tissues: Implications for a Role of Melatonin in Ocular Growth Regulation. Rada SJA; Wiechmann AF. IOVS 2006;47: 25-33.
- Scleral hypoxia is a target for myopia control. Wu H, Chen W, Zhao F. Proc Nat Acad Sci USA 2018; 115 (30): 7091-7100.
- Interventions to slow progression of myopia in children. Jeffrey J Walline, Kristina Lindsley, Satyanarayana S Vedula, Susan A Cotter3, Donald O Mutti1, J. Daniel Twelker. Cochrane Database Syst Rev. 2014; (12): CD004916. doi:10.1002/14651858.CD004916.pub3
- Efficacy Comparison of 16 Interventions for Myopia Control in Children A Network Meta-analysis Jinhai Huang, Daizong Wen, Qinmei Wang, Colm McAlinden, Ian Flitcroft, Haisi Chen, Seang Mei Saw, Hao Chen, Fangjun Bao, Yune Zhao, Liang Hu, Xuexi Li, Rongrong Gao, Weicong Lu, Yaoqiang Du, Zhengxuan Jinag, Ayong Yu, Hengli Lian, Qiuruo Jiang, Ye Yu, Jia Qu. Ophthalmology 2016; 12 (4): 697-708.
- Defcus Incorporated Multiple Segments (DIMS) spectacle lenses slow myopia progression: a 2-year randomized clinical trial. Lam CSY, Tang WC, Tse DY et al. Br J Ophthalmol 2014.
- Effect of spectacle lenses designed to reduce relative peripheral hyperopia on myopia progression in Japanese children: a 2-year multicenter randomized controlled trial. Kanda H, Oshika T, Hiraoka T, et al. Jpn J Ophthalmol 2018; 62 (5): 537-543.
- Defocus Incorporated Soft Contac (DISC) lens slows myopia progression in Hong Kong Chinese schoolchildren: a 2-year randomized clinical trial. Br J Ophthalmol 2014; 9881): 40-45.
- The Longitudinal Orthokeratology Research in Children (LORIC) in Hong Kong: A Pilot Study on Refractive Changes and Myopic Control. Pauline Cho,Sin Wan Cheung, Marion Edwards. Curr Eye Res 2005; 30 (1).
- Discontinuation of ortokeratology on eyeball elongation (DOEE). Cho P, Cheung SW. Contact lens Anterior Eye 2017; 40 829: 82-87.
- The safety of ortokeratology: a systematic review. Eye Contact Lens 2016; 42 (1): 35-42.
- Infectious keratitis and orthokeratology lens use: a systematic review. Ka Wai Kam, Wing Yung, Gabriel Ka Hin Li, Li Jia Chen, Alvin L. Young. Infection 2017; 45:727–735.
- Clinical presentation and morbidity of contact lens–associated microbial keratitis: a retrospective study. Hoddenbach JG, Sharmila S. Boekhoorn, Rene Wubbels, Willem Vreugdenhil, Jeroen Van Rooij , Annette J.M. Geerards . Graefe's Archive for Clinical and Experimental Ophthalmology volume 252, pages299–306(2014).
- Pathogenesis and Prevention of worsening axial elongation in pathological myopia. Pugazhendhi S, ambati B, Hunter AA. Clinical Ophthalmol 2020; 14: 853-873.
- Effects of topical atropine on intraocular pressure and myopia progression. Lee C-Y, Sun CC, Lin YF, et al. BMC Ophthalmol 2016; 16: 114.
- Atropine for the treatment of childhood myopia: safety and efficacy of 0.5%, 0.1% and 0.01% doses. Chia A, Lu QS, Tan D.Ophthalmology 2012; 119 (2): 347-354.
- Five year clinical trial on atropine for the treatment of myopia 2: myopia control with atropine 0.01% eyedrops. Opthalmology 2016; 123 (2): 391-399.
- Update in myopia and treatment strategy of atropine use in myopia control. Wu PC, Chuang MN, Choi J, et al. Eye 2018; 33: 3-13.
- Atropine for the treatment of childhood myopia: effect on myopia progression after cessation of atropine. Tong L, Huang XL, Koh AL, et al. Ophthalmology 2009; 116: 572-9.
- Safety and efficacy of 2% Pirenzepine ophthalmic gel in children with myopia: 1 year, multicentric, double-masked, placebo-controlled parallel study. Arch Ophthalmol 2004; 122 (11): 1667-1674.