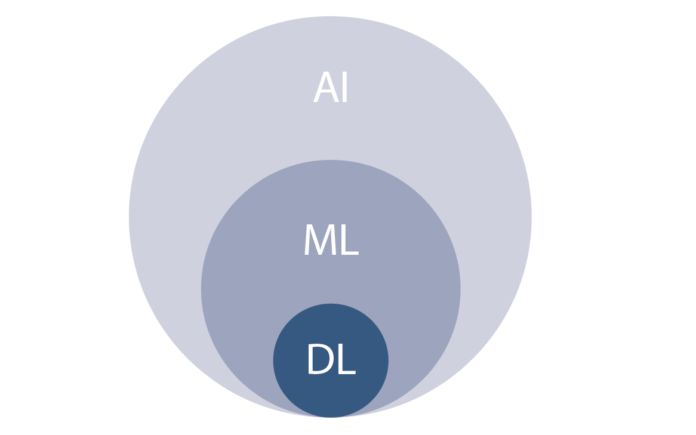
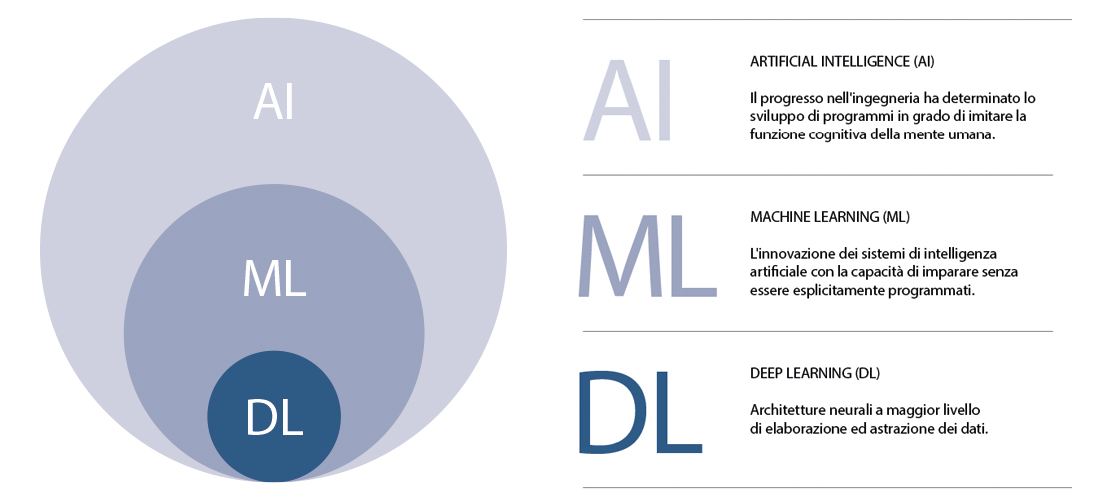
L'intelligenza artificiale (AI) e il machine learning (ML) sono stati ideati dal presupposto che, similmente al sistema cognitivo umano, il computer deve essere in grado di imparare utilizzando tecniche statistiche, senza essere stato precedentemente programmato.
Tramite algoritmi, ML permette di fare previsioni su dati inseriti in una fase di addestramento (training). Il deep learning (DL) rappresenta una implementazione di ML, con un maggior livello di elaborazione e astrazione dei dati. In particolare, il DL si basa sui seguenti elementi: il “cervello”, ovvero reti “neuronali” (dette convolutional neural network, CNN); i campioni di dati, ovvero dataset, per la fase di training e quindi per il miglioramento della capacità di fare previsioni.
Attraverso il continuo allenamento, ogni singolo neurone di una CNN elabora segnali in ingresso, espressi come numeri, suoni o immagini, trasformandoli al pari di un neurone in segnali in uscita tramite semplici calcoli.
La complessità della CNN non è imputabile alla singola unità neuronale virtuale, bensì alla sua fitta rete di connessioni (figura 1).
AI ha riscosso grande successo nei campi con a disposizione grandi quantità di dati, come l’oftalmologia, in cui patologie quali la retinopatia diabetica (DR), la degenerazione maculare legata all'età (AMD), il glaucoma sono in continuo aumento a causa del progressivo invecchiamento della popolazione. Recenti applicazioni della AI hanno riguardato anche la retinopatia del prematuro (ROP), lo studio dei vizi refrattivi e l’identificazione di marker retinici in grado di predire l’insorgenza di comorbidità sistemiche, in particolare di natura cardiovascolare. Le tecniche di DL sono state ampiamente adottate nell’analisi di immagini, quali fotografie del fondo dell'occhio o scansioni alla tomografia a coerenza ottica (OCT) (1).
Nel presente articolo si valuteranno le applicazioni di AI nella diagnosi e nella gestione clinica della degenerazione maculare legata all’età, accennando anche l’esperienza della clinica oculistica dell’Ospedale San Raffaele (Milano) con l’AI nell’AMD.
AI ed AMD (1, 2)
La degenerazione maculare legata all’età rappresenta la principale causa di perdita irreversibile della vista nelle persone di età superiore a 50 anni nei paesi sviluppati. Trattandosi di una condizione cronica, sono richiesti continui monitoraggi per l’identificazione precoce di eventuali segni di ripresa di malattia.
Questo aspetto costituisce una importante problematica, sia per la compliance del paziente, sia per i costi insostenibili per i sistemi sanitari. Per ridurre l'onere del trattamento, è stato adottato l'uso di intervalli di terapie personalizzati che necessitano il monitoraggio dell'attività di malattia solitamente tramite OCT..
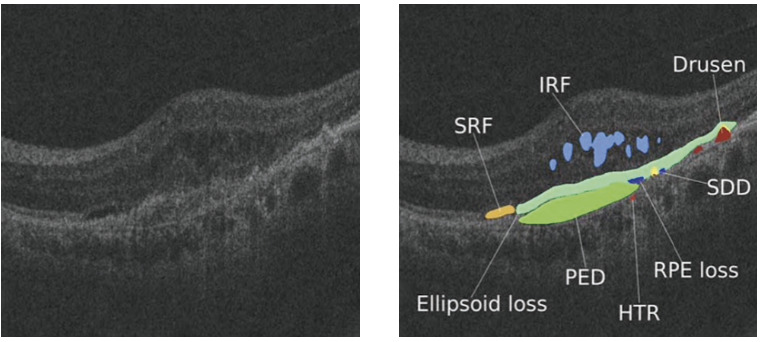
La tomografia a coerenza ottica consente di identificare segni di attività neovascolare, come fluido intraretinico (IRF), fluido sottoretinico (SRF), fluido sotto l’epitelio pigmentato retinico (sub-RPE), materiale iperriflettente sottoretinico (SHRM), e marker di dry AMD, come l'atrofia maculare. È stato dimostrato, ad esempio, che nei pazienti affetti da AMD il fluido intraretinico (IRF), il fluido sub-retinico (SRF) ed i distacchi dell'epitelio pigmentato di tipo neovascolare correlino alla prognosi visiva. La segmentazione tramite algoritmi DL applicati a scansioni OCT potrebbe costituire un approccio affidabile e veloce per rilevare e quantificare automaticamente tali anomalie. Da queste premesse, è derivata l’esigenza di sviluppare algoritmi automatizzati in grado di vicariare il clinico nella gestione dell’AMD. Sono già stati ottenuti risultati promettenti nell'applicazione di tali algoritmi nella classificazione “automatizzata” della degenerazione maculare senile, nella valutazione dell’urgenza di rivalutazione clinica e nella previsione della progressione verso forme neovascolari di AMD. Inoltre, dall’analisi dei suddetti parametri è stato possibile uno studio completo della correlazione struttura/funzione e quindi lo sviluppo di modelli di previsione per la risposta al trattamento e di intervalli di terapia personalizzati.
Seguono alcuni esempi di applicazione degli algoritmi DL nell’ambito dell’AMD, da cui emerge come tale approccio fornisca performance paragonabili o superiori a quelle di un clinico esperto.
Algoritmi DL basati su fotografie del fondo retinico (1)
La maggior parte degli algoritmi DL applicati su fotografie del fundus oculi ha svolto un’eccellente performance nell’identificare AMD a partire dallo stadio intermedio. Secondo uno dei primi algoritmi ideati, le alterazioni venivano classificate in forma binaria come riferibile o non riferibile ad AMD, mostrando valori ottimali di specificità e sensibilità (pari a 1 e 0,0994, rispettivamente). In aggiunta, è stato ideato un sistema DL basato sulla scala AREDS e suddiviso in 13 classi. Sebbene la sensibilità e specificità medie (complessivamente su tutte classi) possono sembrare relativamente ridotte a causa delle minime differenze tra classi adiacenti, aggregando le 13 classi in 3 gruppi, le performance migliorano notevolmente, con valori più significativi per la AMD in fase avanzata (classi AREDS 10-12). Inoltre, gli algoritmi di DL non sono stati impiegati esclusivamente nella diagnostica, bensì anche nel fornire una stima del rischio di progressione di AMD, con elevati livelli di precisione (rischio di progressione a 5 anni con errore medio pari a 3,5% e il 5,3%) (3).
Algoritmi DL basati sull'OCT (1,2)
Come già accennato, differenti sono le applicazioni degli algoritmi DL basati su scansioni OCT. Tra questi figurano l’identificazione di potenziali anomalie, la segmentazione delle immagini e l’attribuzione di un loro significato prognostico. Sono stati progettati algoritmi DL basati sull’OCT per l’identificazione di anomalie quali fluido intraretinico, drusen, pseudodrusen, distacco dell’epitelio pigmentato (PED) ed atrofia geografica, con elevati valori di sensibilità e specificità (figura 2). Inoltre, alcuni sistemi di deep learning sono in grado di classificare gli OCT in termini di “urgenza” con cui dovrebbe essere effettuata una valutazione clinica (urgente, semi-urgente, routine e solo osservazione). In alcuni lavori scientifici, DL è stato utilizzato per effettuare correlazioni tra la progressione di AMD e parametri clinico-funzionali. In particolare, Schmidt-Erfurth ed i suoi collaboratori ha valutato tramite DL la correlazione tra PED e acuità visiva (VA) in pazienti con AMD neovascolare dopo trattamento intravitreale con Ranibizumab (4). Nello specifico, hanno applicato alle scansioni OCT algoritmi di segmentazione automatica per identificare marker quali IRF, SRF e PED e prevedere l'acuità visiva al baseline (tempo 0) e dopo 12 mesi dal trattamento. In tale lavoro, si è osservato che SRF e PED non contribuivano significativamente al valore di acuità visiva al tempo 0. Infine, è stato valutato il rischio di progressione verso l’AMD neovascolare nello stesso occhio o nell’occhio controlaterale, con elevati valori di sensibilità e specificità (pari a 0,80 e 0,55, rispettivamente) (5).
 La nostra esperienza nell’applicazione di algoritmi di AI nell’AMD
La nostra esperienza nell’applicazione di algoritmi di AI nell’AMD
Come accennato, sono stati proposti differenti algoritmi DL per lo studio della degenerazione maculare senile. Una limitazione di molti è stata l’analisi di una singola o di un ristretto gruppo di caratteristiche morfo-funzionali. In altri lavori, in cui sono state esaminate contemporaneamente un maggior numero di parametri, non sono state oggettivate quantitativamente le prestazioni dell’algoritmo DL. Inoltre, non essendo stati condotti molti studi real-world, tale approccio non è stato ancora attualmente integrato nella pratica clinica, né ha permesso di valutare la risposta alla terapia anti-angiogenica al di fuori di studi clinici (6). Da queste premesse, è derivato il lavoro del nostro gruppo in cui abbiamo sviluppato un algoritmo di DL basato su scansioni OCT, capace di identificare autonomamente marker di attività quali IRF, SRF e PED neovascolari. Sono stati valutati retrospettivamente occhi affetti da AMD neovascolare essudativa. L’analisi dei dati ha mostrato che l’algoritmo identifica accuratamente tali marker, dimostrando ulteriormente come i modelli di deep learning siano accurati al pari di un esperto clinico.
Dir ezioni future e potenziali sfide per l’applicazione della AI nella gestione di AMD (1,2)
ezioni future e potenziali sfide per l’applicazione della AI nella gestione di AMD (1,2)
La ricerca nelle tecniche DL permetterà l’applicazione di tali algoritmi su larga scala e la riduzione del rapporto costo-beneficio. Oltre all’ambito degli screening, il deep learning permetterà una migliore stratificazione del rischio, con previsioni sull’ esito funzionale e strutturale dei pazienti AMD, e quindi sul migliore trattamento disponibile nel caso specifico. Nonostante i promettenti sviluppi, il futuro di questo campo non appare scevro da limitazioni da superare e che tuttora ne condizionano l’applicazione in pratica clinica. Tra questi, emerge l’elevato numero di immagini richieste in tali analisi, che sfortunatamente è disponibile soltanto per patologie ad elevate incidenza/prevalenza, a discapito di condizioni morbose che, essendo meno frequenti, non possono beneficiare di tale tecnologia.
Conclusioni
L’applicazione dell’AI potrebbe rappresentare la risposta all’invecchiamento della popolazione mondiale, al rapido sviluppo dei paesi a basso reddito e all’attuale pandemia globale. Nello specifico, lo screening automatizzato di malattie oculari comporterebbe diagnosi anticipata, trattamento tempestivo e personalizzato per ogni paziente, con migliore aderenza terapeutica e, di conseguenza, una migliore qualità di vita. Se così fosse, AI potrebbe apportare una vera e propria rivoluzione nell’ambito dell’oftalmologia, in particolare in contesti a basso reddito dove mancano un adeguato numero di esperti in grado di fronteggiare il progressivo aumento di patologie croniche oculari, tra cui spicca anche la degenerazione maculare legata all’età.
Bibliografia
1. Ting DSW, Peng L, Varadarajan A V., et al. Deep learning in ophthalmology: The technical and clinical considerations. Prog Retin Eye Res. 2019;72(April):100759. doi:10.1016/j.preteyeres.2019.04.003
2. Benet D, Pellicer-Valero OJ. Artificial intelligence: the unstoppable revolution in ophthalmology. Surv Ophthalmol. 2022;67(1):252-270. doi:10.1016/j.survophthal.2021.03.003
3. Burlina PM, Joshi N, Pacheco KD, Freund DE, Kong J, Bressler NM. Use of Deep Learning for Detailed Severity Characterization and Estimation of 5-Year Risk among Patients with Age-Related Macular Degeneration. JAMA Ophthalmol. 2018;136(12):1359-1366. doi:10.1001/jamaophthalmol.2018.4118
4. Schmidt-Erfurth U, Bogunovic H, Sadeghipour A, et al. Machine Learning to Analyze the Prognostic Value of Current Imaging Biomarkers in Neovascular Age-Related Macular Degeneration. Ophthalmol Retin. 2018;2(1):24-30. doi:10.1016/j.oret.2017.03.015
5. Yim J, Chopra R, Spitz T, et al. Predicting conversion to wet age-related macular degeneration using deep learning. Nat Med. 2020;26(6):892-899. doi:10.1038/s41591-020-0867-7
6. Liefers B, Taylor P, Alsaedi A, et al. Quantification of Key Retinal Features in Early and Late Age-Related Macular Degeneration Using Deep Learning. Am J Ophthalmol. 2021;226:1-12. doi:10.1016/j.ajo.2020.12.034