Il coronavirus 2 da sindrome respiratoria acuta grave (SARS-Co-V2) è un nuovo ceppo facente parte del genere Betacoronavirus, identificato intorno alla fine del 2019, che condivide l’89% dei nucleotidi con il SARSlike-CoV-ZXC2, diffuso nei pipistrelli, e l'82% con il SARS-CoV umano.
Il meccanismo che permette l’infezione sembra essere dovuto al legame fra le proteine di superficie del SARS-CoV-2 e il recettore dell'enzima di conversione dell'angiotensina 2 (ACE2), particolarmente espresso a livello polmonare nell’uomo. Inoltre, recentemente è stato dimostrato che due proteasi umane, la serin-proteasi TMPRSS2 e la furin-proteasi, risultano fondamentali per la realizzazione di tale legame. Il recettore ACE2 è responsabile anche dell’infezione da SARS-CoV.
Entrambi i tipi di virus presentano un'elevata trasmissibilità da uomo a uomo e possono causare un grave quadro di malattia respiratoria acuta.
La ricerca e l’identificazione dell’agente virale a livello tissutale e dei fluidi biologici ricoprono un ruolo fondamentale nel controllo delle malattie trasmissibili.
Questo aspetto è stato ed è tuttora una questione centrale nella gestione della crisi sanitaria globale della pandemia da malattia di Coronavirus 2019 (COVID-19).
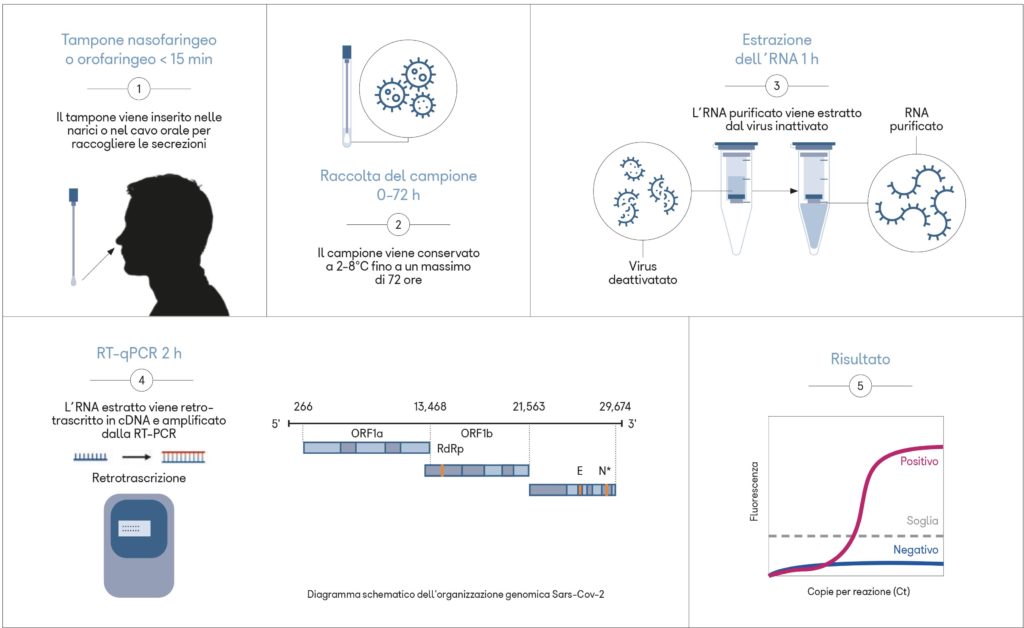
I saggi basati sulla reazione a catena della polimerasi della trascrittasi inversa in tempo reale (Real Time PCR) per il rilevamento di SARS-CoV-2, eseguiti con prelievo dalle mucose nasofaringee ed orofaringee, sono l'attuale standard di riferimento per la diagnosi di COVID-19. Per limitare la diffusione dell'infezione, questi vengono anche utilizzati per tracciare i pazienti asintomatici.

Recenti studi hanno valutato la presenza del SARS-CoV-2 in campioni biologici diversi da quelli del tratto respiratorio come feci, saliva, urina, liquido seminale e lacrime (1-4).
Fino ad ora, i dati pubblicati sul coinvolgimento della superficie oculare, in particolare della mucosa congiuntivale e dell'epitelio corneale, sono pochi e non coerenti.
Recentemente, il SARS-CoV-2 è stato identificato nelle lacrime, come avvenne per il SARS-CoV nel 2003.
L'espressione di ACE2 e di TMPRSS2 è stata rilevata in diversi tessuti del corpo umano (come mucosa alveolare polmonare, mucosa orale, dotto gastrointestinale, rene), e più recentemente a livello corneale e congiuntivale, dove sono entrambi co-espressi.
Questi risultati suggeriscono che la superficie oculare possa rappresentare un possibile sito di infezione primario e un potenziale serbatoio per la sua diffusione (5,6). Sebbene l’espressione del recettore ACE2 a livello congiuntivale sia inferiore rispetto a quella polmonare, questo potrebbe comunque mediare l’infezione da SARS-CoV-2 a livello della superficie oculare.
Fino ad ora, pochi studi e con risultati contrastanti hanno indagato il ruolo diagnostico del tampone congiuntivale nel rilevamento del SARS-CoV-2 a livello oculare in pazienti affetti da COVID-19 (7-9).
La maggior parte di questi soffrono di un design di tipo retrospettivo e sono stati condotti su un numero molto limitato di soggetti. La percentuale dei tamponi congiuntivali positivi in studi condotti nella regione dell’Hubei in Cina centro-orientale – area di prima insorgenza dell’epidemia - varia dal 2,5 - 15% (10).
È interessante notare che in alcuni studi la positività del tampone congiuntivale persisteva per più tempo rispetto a quella del tampone rinofaringeo. Per quanto riguarda la prevalenza dei segni clinici oculari come rossore e congiuntivite, questa varia dal 1% al 30% (10).
La forte disomogeneità dei risultati può essere secondaria al fatto che, non essendo l’occhio il target principale della malattia, i pazienti affetti da COVID-19 non sono stati indagati in maniera sistematica per quanto riguarda tale distretto.
È infatti possibile che questi dati siano fortemente sottostimati e pertanto sono auspicabili nuovi studi prospettici per meglio definire il coinvolgimento della superficie oculare in questa patologia.
La standardizzazione e la validazione di un metodo per il rilevamento del SARS-CoV-2 sulla superficie oculare potrebbero essere utili per implementare il processo di diagnosi e il monitoraggio del decorso della malattia nel tempo
La superficie oculare
come barriera difensiva per i patogeni
Il sistema definito come superficie oculare comprende l'epitelio corneale, la congiuntiva, il limbus sclero-corneale, il film lacrimale, le ghiandole di Meibomio e le altre ghiandole secondarie a livello palpebrale, le ghiandole lacrimali, le ciglia e il dotto naso-lacrimale.
Le varie componenti di questo sistema risultano integrate fra di loro grazie alla coordinazione attuata dal sistema nervoso, endocrino, vascolare e immunitario. Questi infatti permettono che la superficie risulti trasparente e speculare a livello corneale e che funga da barriera difensiva primaria nei confronti di agenti ambientali irritanti, allergeni e agenti patogeni.
Tutti gli epiteli della superficie oculare sono continui fra di loro e attraverso il dotto naso-lacrimale risultano in continuità con il sistema respiratorio, con il quale condividono proprietà funzionali e immunitarie.
 La risposta immunitaria deve essere modulata con precisione e, quando necessario, determinare il reclutamento di cellule immunitarie competenti, per contrastare le infezioni da parte di patogeni che possono compromettere la trasparenza corneale.
La risposta immunitaria deve essere modulata con precisione e, quando necessario, determinare il reclutamento di cellule immunitarie competenti, per contrastare le infezioni da parte di patogeni che possono compromettere la trasparenza corneale.
Le cellule epiteliali corneali e congiuntivali sono unite da giunzioni aderenti che agiscono come una barriera fisica contro l'ambiente esterno.
Le giunzioni aderenti sono collocate al di sopra di tessuto connettivo che si presenta più lasso a livello della congiuntiva e altamente organizzato e compatto a livello corneale. Sia l'epitelio che il tessuto connettivo presentano cellule residenti immunocompetenti, appartenenti al sistema immunitario, come linfociti T CD8 + e CD4 +, macrofagi (CD68 +) e cellule di Langherans.
La prima linea di difesa della superficie oculare è rappresentata dall’integrità del film lacrimale che, in condizioni normali, protegge la superficie dall'ambiente esterno.
L'attività antimicrobica delle lacrime rappresenta un fondamentale meccanismo innato di difesa ed è esercitata attraverso: i) l’ammiccamento delle palpebre e la lacrimazione riflessa che permetto la pulizia della superficie; ii) l’inibizione e/o l’uccisione di microrganismi da parte di diverse proteine antimicrobiche (tra cui lisozima, lactoferrina, lipocalina, immunoglobulina A; iii) la capacità di alcune glicoproteine ad alto peso molecolare, come le mucine, di bloccare e intrappolare i microrganismi.
Il ruolo della superficie oculare
nell'infezione da SARS-CoV-2
La superficie oculare rappresenta un sito del corpo umano particolarmente esposto al contatto con goccioline contaminate e infettive, similmente alla mucosa del tratto respiratorio. Data la connessione anatomica e l'interdipendenza immunologica tra occhio e naso, la superficie oculare può essere considerata come una possibile via per l'infezione del sistema respiratorio.
Le mucose del tratto oculare e respiratorio condividono i recettori che permettono il legame con le proteine di superficie di diversi virus respiratori. Tali recettori infatti presentano un tropismo oculare variabile, ma che spesso è sufficiente a determinare l’infezione del tratto respiratorio dopo un primo contatto del virus con l'occhio.
I virus respiratori, quando non vengono neutralizzati dal sistema immunitario, sono in grado di replicarsi nelle cellule epiteliali della superficie oculare oppure possono drenare con le lacrime nel dotto naso-lacrimale e infettare il tratto respiratorio.
L'adenovirus e il virus dell'influenza, dato il loro tropismo per le cellule congiuntivali, sono spesso causa di quadri severi di congiuntivite e cheratocongiuntivite epidemiche.
Precedenti studi indicano che le infezioni da coronavirus nell'uomo si associano raramente a complicanze a livello dell’occhio, ma suggeriscono che l'esposizione oculare possa rappresentare contemporaneamente una via di accesso e di trasmissione del virus.
In pazienti affetti da polmonite da SARS-CoV è stato riscontrato che il virus viene trasmesso anche attraverso il contatto con le mucose degli occhi, come suggerito da una maggiore trasmissione della SARS da pazienti infetti a operatori sanitari senza protezione oculare (11-12).
Sebbene nel 2003 le lacrime siano state incluse dall'Organizzazione mondiale della sanità fra i fluidi corporei potenzialmente contenenti SARS-CoV, il relativo impatto clinico non è ancora stato chiarito.
Recenti studi in vitro hanno confrontato il comportamento di SARS-CoV, SARS-CoV-2, MERS-CoV e virus dell'influenza H5N1 a livello delle cellule congiuntivali e hanno dimostrato come la replicazione del SARS-CoV-2 sia maggiore di quella del SARS-CoV e che esso determina una minor rilascio di citochine pro-infiammatorie rispetto agli altri virus presi in esame (13).
Questo potrebbe significare che il SARS-CoV-2 possiede un forte tropismo per la superficie oculare pur non determinando un marcato coinvolgimento a livello locale.
Superficie oculare e diagnosi di laboratorio di COVID-19: limiti e prospettive future delle metodiche attuali
L’identificazione di un test diagnostico sensibile e specifico da utilizzare sia in fase di screening nei soggetti asintomatici, sia nei pazienti sintomatici a conferma della presenza di malattia, sia durante la convalescenza di questi ultimi con lo scopo di identificare i pazienti guariti e potenzialmente immuni è di fondamentale importanza nel contrastare la pandemia.
La variabilità dei risultati circa il rilevamento del SARS-CoV-2 a livello della superfice oculare è stata attribuita all’inefficienza dei sistemi di diagnosi attualmente in uso, e purtroppo gli studi pubblicati sino ad ora risultano spesso carenti nella descrizione degli aspetti tecnici delle metodiche utilizzate (8).
A tal proposito, possono essere fatte alcune considerazione. I protocolli specifici di Real Time - PCR attualmente in uso potrebbero risentire di una bassa sensibilità nel rilevare il SARS-CoV-2 in campioni congiuntivali e lacrimali, che andrebbe dal 50% al 60%.
Questo potrebbe essere dovuto alle piccole quantità di RNA virale presenti in queste secrezioni, anche in funzione del fatto che queste variano durante il decorso della malattia, come già dimostrato nel caso del Coronavirus della sindrome respiratoria medio-orientale (MERS-CoV).
Anche il tempo di campionamento, infatti, ricopre un ruolo fondamentale nell’individuazione dei virus. Nel caso del MERS-CoV, si era visto che i campioni congiuntivali raccolti nella fase avanzata della malattia fossero negativi mentre erano positivi quelli raccolti nella fase iniziale. Al contrario, nel caso del SARS-CoV-2 sembrerebbe che la presenza di RNA virale possa essere prolungata nel tempo, rimanendo positiva anche due settimane dopo la negativizzazione dei tamponi nasali e faringei.
Tuttavia, i risultati degli studi condotti fino ad ora non sono ancora sufficienti a trarre conclusioni definitive circa la presenza del virus a livello oculare e quindi l’efficacia dei metodi di diagnosi (8).
Per ottenere risultati consistenti sono necessari studi con un campione di dimensioni adeguate sul quale devono essere eseguiti tamponi ripetuti a livello congiuntivale/lacrime nel corso della malattia.
Inoltre, la tecnica di raccolta necessita di essere il più possibile standardizzata.
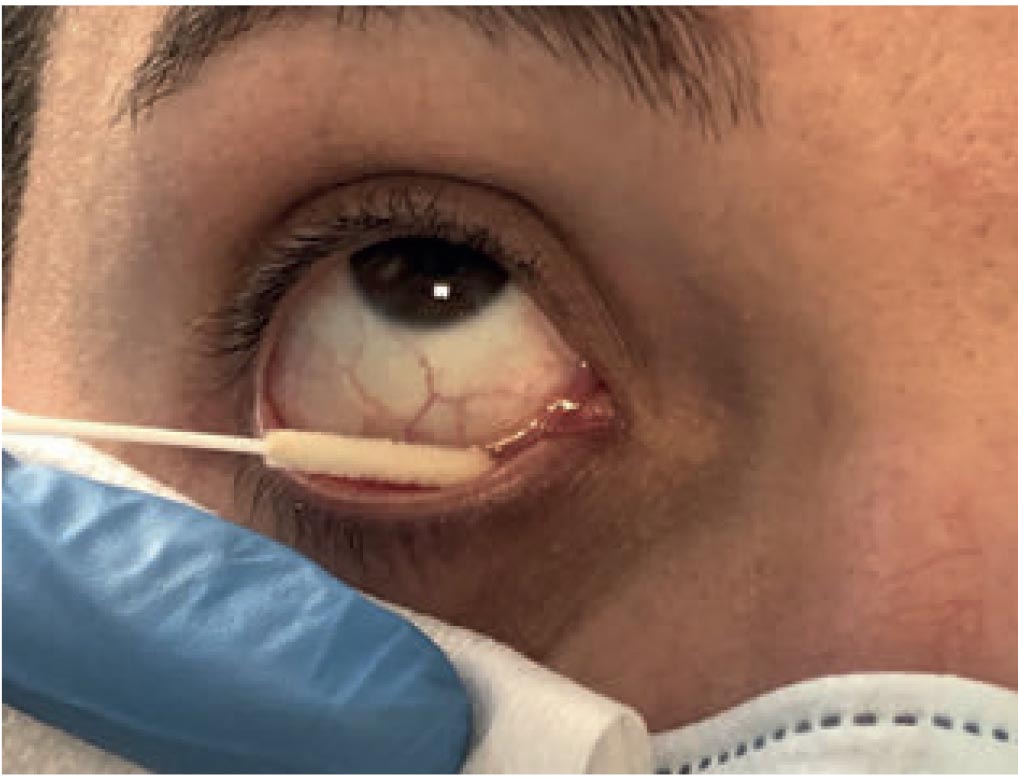
L'Organizzazione Mondiale della Sanità raccomanda, per la raccolta dei campioni, l'uso di tamponi di fibre sintetiche anziché di tamponi di alginato di calcio, i quali possono contenere sostanze che interferiscono con i test di PCR.
Allo stesso modo, l'anestesia topica non è raccomandata per la raccolta di campioni lacrimali e congiuntivali, poiché potrebbe influenzare negativamente la vitalità virale. In figura 1 viene mostrato il posizionamento corretto a livello del fornice congiuntivale del tampone di prelievo.
Conclusioni
In sintesi, ci sono prove evidenti che il SARS-CoV-2 interagisca con la superficie oculare. A causa della sua struttura anatomica e funzionale, la superficie oculare potrebbe rappresentare una potenziale via di infezione e consentire sia l’accesso che l’eliminazione (clearance) del virus.
Sebbene gli studi condotti sino ad ora sul coinvolgimento della superficie oculare abbiano dato risultati contrastanti non vi è ancora un consenso sulle tecniche metodologiche da applicare per rilevare efficacemente SARS-CoV-2 a livello oculare (8).
Il sito dell’Organizzazione Mondiale della Sanità mette a disposizione una sezione costantemente aggiornata nella quale vengono presentati i nuovi kit diagnostici per il rilevamento del SARS-CoV-2 (https://www.who.int/emergencies/diseases/novel-coronavirus-2019/technical-guidance-publicationshttps://www.who.int/emergencies/diseases/novel-coronavirus-2019/technical-guidance-publications).
La standardizzazione e la validazione di un metodo per il rilevamento del SARS-CoV-2 sulla superficie oculare potrebbero essere utili per implementare il processo di diagnosi e il monitoraggio del decorso della malattia nel tempo.
Biblografia
- Paoli D, Pallotti F, Colangelo S, Basilico F, Mazzuti L, et al. (2020): Study of SARS-CoV-2 in semen and urine samples of a volunteer with positive naso-pharyngeal swab. J Endocrinol Invest. 1-4
- Williams E, Bond K, Zhang B, Putland M, Williamson DA. (2020). Saliva as a non-invasive specimen for detection of SARS-CoV-2. Journal of Clinical Microbiology. JCM.00776-20
- Peng L, Liu J, Xu W, Luo Q, Chen D, et al. (2020). SARS-CoV-2 can be detected in urine, blood, anal swabs, and oropharyngeal swabs specimens. J Med Virol. 10.1002/jmv.25936
- Chen Y, Chen L, Deng Q, Zhang G, Wu K, et al. (2020): The presence of SARS-CoV-2 RNA in the feces of COVID-19 patients. J Med Virol. 92:833-840.
- Leonardi A, Rosani U, Brun P. Ocular Surface Expression of SARS-CoV-2 Receptors [published online ahead of print, 2020 Jun 26]. Ocul Immunol Inflamm. 2020;1-4.
- Zhou L, Xu Z, Castiglione GM, Soiberman US, Eberhart CG, Duh EJ. ACE2 and TMPRSS2 are expressed on the human ocular surface, suggesting susceptibility to SARS- CoV-2 infection. Preprint. bioRxiv. 2020;2020.05.09.086165. Published 2020 May 9.
- Chen L, Deng C, Chen X, Zhang X, Chen B, et al. (2020). Ocular manifestations and clinical characteristics of 535 cases of COVID-19 in Wuhan, China: a cross-sectional study. Acta Ophthalmol. 10.1111/aos.14472
- Deeks JJ, Dinnes J, Takwoingi Y, Davenport C, Leeflang MMG, et al. (2020). Diagnosis of SARS‐CoV‐2 infection and COVID‐19: accuracy of signs and symptoms; molecular, antigen, and antibody tests; and routine laboratory markers. Cochrane Database of Systematic Reviews.
- Wu P, Duan F, Luo C, Liu Q, Qu X, et al. (2020). Characteristics of Ocular Findings of Patients With Coronavirus Disease 2019 (COVID-19) in Hubei Province, China. JAMA Ophthalmol. 138:575-578
- Bernabei F, Versura P, Rossini G, Re MC. There is a Role in Detection of SARS-CoV-2 in Conjunctiva and Tears. New Microbiologica July 2020 In press
- Peiris JSM, Yuen KY, Osterhaus ADME, Stöhr K. (2003). The severe acute respiratory syndrome. N Engl J Med. 349: 2431–2441.
- Raboud J, Shigayeva A, McGeer A, Bontovics E, Chapman M, et al. (2010). Risk Factors for SARS Transmission from Patients Requiring Intubation: A Multicentre Investigation in Toronto, Canada. PLOS ONE 5:e10717
- Hui KPY, Cheung M-C, Perera RAPM, Nicholls JM, Sachs N, et al. (2020): Tropism, replication competence, and innate immune responses of the coronavirus SARS-CoV-2 in human respiratory tract and conjunctiva: an analysis in ex-vivo and in-vitro cultures. Lancet Respir Med. 6:846-854








