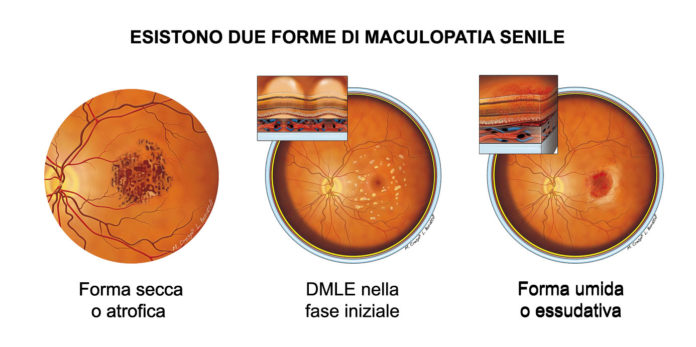
La degenerazione maculare legata all'età (DMLE) neovascolare, contraddistinta dalla presenza di una rete neovascolare patologica a livello della coroide (neovascolarizzazione coroideale, CNV), rappresenta una delle due forme di DMLE evoluta, insieme all’atrofia geografica. Nonostante solo il 10-15% dei casi di DMLE sia riconducibile a tale categoria, è responsabile della maggiore quota di perdita visiva nei soggetti affetti da DMLE (1-3).
La prevalenza della DMLE in generale, e di conseguenza anche della DMLE essudativa, è in aumento a causa dell’invecchiamento globale della popolazione; tuttavia, l’impatto funzionale legato alla forma neovascolare ha riscontrato una brusca riduzione dopo l’introduzione delle terapie intravitreali a base di inibitori del fattore di crescita endoteliale vascolare (VEGF). Attualmente, i farmaci anti-VEGF somministrati mediante iniezione in camera vitrea rappresentano la terapia di riferimento nella maggior parte delle forme di DMLE neovascolare, in assenza di controindicazioni sistemiche o locali.
I farmaci attualmente disponibili ed approvati in Italia per la terapia della DMLE essudativa sono il ranibizumab e l’aflibercept. Il primo è un frammento di anticorpo monoclonale (Fab) derivato dall'anticorpo similare murino bevacizumab. L’aflibercept, invece, non è un anticorpo monoclonale, bensì una proteina di fusione ricombinante composta da frammenti di recettori del VEGF, fusi con la porzione Fc dell’IgG1 umana. Questa composizione garantisce un’elevata affinità per il VEGF, superiore a quella dei recettori nativi.
L’aflibercept è in grado di bloccare anche il placental growth factor (PlGF), un ulteriore fattore di crescita espresso dall’endotelio. Diversi nuovi farmaci ad azione anti-VEGF si stanno per affiancare alle attuali molecole. Tra questi, il più promettente e prossimo all’approvazione da parte dell’FDA è il brolucizumab, un frammento di anticorpo a singola catena, dal peso molecolare estremamente basso (26 kDa), composto da frammenti che legano tutte le isoforme di VEGF-A (figura 1) (4).


I frammenti di anticorpi a singola catena sono caratterizzati da piccole dimensioni, ottima penetrazione tissutale, rapida clearance dalla circolazione sistemica e caratteristiche posologiche molto favorevoli. Gli studi in vitro hanno dimostrato che, a parità di volume iniettato, si ottiene una dose intravitreale circa 11-12% volte maggiore del ranibizumab.
Disegno dello studio
Con oltre 1800 pazienti in 400 centri nel mondo, HAWK e HARRIER sono i primi e unici studi clinici di fase III randomizzati, in doppio cieco, della durata di 96 settimane condotti in pazienti con DMLE neovascolare che hanno testato in modo prospettico gli effetti di brolucizumab q8w/q12e contro aflibercept q8w (5). Gli occhi sono stati randomizzati 1: 1: 1 a brolucizumab 3 mg, brolucizumab 6 mg o aflibercept 2 mg (HAWK) o 1: 1 a brolucizumab 6 mg o aflibercept 2 mg (HARRIER).
Dopo 3 iniezioni alle settimane 0, 4 e 8 (fase di carico), il brolucizumab è stato iniettato ogni 12 settimane a meno che non venissero identificati segni di attività di malattia, con conseguente adeguamento permanente a somministrazione ogni 8 settimane; l’aflibercept è stato sempre iniettato ogni 8 settimane. L'endpoint primario era la variazione media dell’acuità visiva al meglio corretta (BCVA) dal basale alla settimana 48.
Gli endpoint secondari comprendevano la variazione della BCVA rispetto al basale alla settimana 36 e alla settimana 48 e lo stato del trattamento q12w alla settimana 48 (solo brolucizumab). Ulteriori endpoint secondari di efficacia includevano, per ogni visita post-baseline, variazioni rispetto al basale in BCVA e spessore retinico centrale (CST, central subfield thickness), presenza di fluido intraretinico (IRF, intra-retinal fluid) e/o fluido sotto-retinico (SRF, sub-retinal fluid), due importanti marcatori di attività di malattia.
Risultati
In entrambi gli studi, il brolucizumab 6 mg somministrato ogni 12 settimane, si è dimostrato non inferiore in termini di guadagno visivo rispetto ad aflibercept somministrato ogni 8 settimane a 48 settimane. A un anno, è stato calcolato un cambiamento medio dell’acuità visiva di 6,6 lettere nel braccio trattato con brolucizumab 6 mg contro 6,8 lettere nel braccio trattato con aflibercept nello studio HAWK e di 6,9 lettere contro 7,6 lettere, rispettivamente, nello studio HARRIER.
Negli occhi trattati con brolucizumab, le probabilità di mantenere la dose di q12w dopo la dose di carico fino alla settimana 48 erano di 49,4% (3 mg) e 55,6% (6 mg) in HAWK e 51% (6 mg) in HARRIER. Negli occhi trattati con brolucizumab che non mostravano segni di attività di malattia durante il primo intervallo di 12 settimane, le probabilità di rimanere a un dosaggio di q12w fino alla settimana 48 erano di '80,9% (3 mg) e 85,4% (6 mg) nello studio HAWK e 81,7% (6 mg) nello studio HARRIER.
Dei pazienti trattati con brolucizumab 6 mg che avevano completato con successo il primo anno con un intervallo di dosaggio di 12 settimane, l’82% in HAWK e il 75% in HARRIER sono stati mantenuti nell’intervallo di dosaggio di 12 settimane anche nel secondo anno.
Alla settimana 16, un minor numero di occhi trattati con brolucizumab 6 mg mostrava segni di attività di malattia rispetto ad aflibercept in HAWK (24,0% vs 34,5%; p = 0001) e HARRIER (22,7% vs 32,2%; P = 0,002), rivelando formalmente così una superiorità di effetto rispetto a aflibercept in entrambi gli studi. Dal punto di vista morfologico, una maggiore riduzione del CST dal basale alla settimana 16 sono state osservate negli gli occhi trattati con brolucizumab 6 mg rispetto ad aflibercept in entrambi gli studi; risultati simili sono stati osservati alla settimana 48 in HAWK (172,8 vs 143,7 mm, p<0,001) e HARRIER (193,8 vs 143,9 mm; p <0,001).
Anche la presenza di IRF e/o SRF era minore negli occhi trattati con brolucizumab rispetto agli occhi trattati con aflibercept sia alla settimana 16 sia 48 in HAWK (3 mg e 6 mg) e HARRIER, con una dimostrazione formale di superiorità statistica rispetto a aflibercept nello studio HAWK alla settimana 48. In termini di sicurezza il farmaco si è dimostrato comparabile all’aflibercept, con un’incidenza complessiva di eventi avversi equiparabile tra i due gruppi. Gli eventi avversi oculari più frequenti sono stati: riduzione dell’acuità visiva, emorragia congiuntivale, corpi mobili vitreali e dolore oculare.
Conclusioni
Gli studi HAWK e HARRIER hanno raggiunto l'endpoint primario di non inferiorità in BCVA di brolucizumab rispetto a aflibercept, con >50% dei pazienti mantenuti a brolucizumab 6 mg somministrato ogni 12 settimane fino alla settimana 48. Inoltre, hanno dimostrato una superiorità in termini di controllo di malattia di brolucizumab rispetto ad aflibercept.
La risposta morfologica e funzionale dei pazienti durante il primo intervallo di q12w ha rivelato un buon valore predittivo del comportamento a 48 settimane, consentendo potenzialmente agli oftalmologi di determinare quali pazienti siano più adatti a continuare il dosaggio di q12w e quali invece vadano mantenuti a un trattamento ogni 8 settimane.
In conclusione, gli studi HAWK e HARRIER hanno valutato con successo un'opzione terapeutica alternativa alle terapie già approvate per la DMLE essudativa, che combina la durata prolungata dell'effetto di brolucizumab con un'efficacia favorevole, consentendo una pianificazione efficace del trattamento e un carico di economico e di visite oculistiche minore. Visti i positivi risultati ottenuti, nuovi studi di fase III sono in corso per il trattamento dell’edema macuclare diabetico.