La coroide è lo strato vascolare dell’occhio e fornisce sostanze nutritive agli strati retinici esterni, i quali sono i più colpiti dalla DMLE. La vascolarizzazione retinica influisce sulla patogenesi della degenerazione maculare legata all’età. Infatti, la diminuzione della perfusione coroideale è correlata alla disfunzione dell’epitelio pigmentato retinico e alla gravità della malattia stessa. Tale reperto implica che le anomalie vascolari responsabili della riduzione del flusso sanguigno a livello coroideale possano originare dai vasi antecedenti, dunque dall’arteria oftalmica e dall’arteria carotide interna. La seguente narrazione offre spunti di riflessione riguardo questa nuova ipotesi patogenetica e la concretezza di una terapia eziologica differente rispetto alle iniezioni intravitreali di sostanze terapeutiche già ampiamente utilizzate nella pratica clinica.
La degenerazione maculare legata all'età (DMLE) è una malattia gradualmente progressiva caratterizzata da un danno irreversibile della macula con conseguente perdita della visione centrale (1-2) e si divide in 3 fasi: precoce, intermedia e tardiva (3). È attualmente la causa principale di cecità tra gli anziani nel mondo sviluppato (4).
Si tratta di una patologia complessa con molteplici fattori di rischio genetici e ambientali. È noto che lo stress ossidativo e l'ipossia possono favorire l'attivazione del complemento (5-6) promuovendone la progressione. Il microcircolo oculare è compromesso a causa dell'invecchiamento e le malattie vascolari contribuiscono alla disfunzione retinica. Pertanto, le patologie cardiovascolari e il tabagismo, insieme all’età e alla dieta, rientrano tra i fattori di rischio per il suo sviluppo (7-8).
La riduzione della perfusione coroideale gioca un ruolo nella disfunzione dell’epitelio pigmentato retinico, nella gravità della DMLE e nello sviluppo di atrofia e di neovascolarizzazione.
Gli strati retinici più colpiti nella DMLE sono quelli esterni, i quali ricevono la maggior parte del supporto nutrizionale dalla coroide, lo strato vascolare dell’occhio. La riduzione della perfusione coroideale, già dimostrata in precedenti studi (9-10), gioca un ruolo nella disfunzione dell’epitelio pigmentato retinico, nella gravità della patologia e nello sviluppo di atrofia e di neovascolarizzazione (12).
Uno degli aspetti anatomici da considerare è che la vascolarizzazione coroideale deriva principalmente dall’arteria oftalmica (AO), la quale è il primo ramo marginale dell’arteria carotide interna (ACI).
Fisiopatologia vascolare della DMLE
Un recente studio osservazionale pubblicato sull’American Society of Neuroradiology ha cercato di valutare se anche la vascolarizzazione a monte della coroide, ossia l'arteria oftalmica e/o l’arteria carotide interna, contribuisce alla diminuzione della perfusione retinica nei pazienti affetti da DMLE. Tutti i soggetti sono stati sottoposti ad una risonanza magnetica angiografica Magnetom da 7 Tesla per ottenere misure ad alta risoluzione del flusso sanguigno e del calibro di AO e ACI senza l'uso di mezzi di contrasto intravascolare. Lo strumento è stato regolato in modo da avere una misura accurata delle arterie di piccolo calibro come l’AO. Nelle analisi dei flussi di AO normalizzati alle velocità di flusso ACI a monte, solo le coppie AO-ACI con i dati più accurati sono state incluse nell’analisi statistica. È stata riscontrata una differenza delle velocità medie di flusso tra i controlli e i pazienti sia nell'AO che nell'ACI. Le portate volumetriche medie attraverso l’AO erano significativamente più basse rispetto ai controlli soltanto nei pazienti con DMLE tardiva, mentre tale parametro a livello dell'ACI era simile tra i due gruppi. Inoltre, è stata individuata un'associazione statisticamente significativa tra la riduzione dei flussi volumetrici attraverso l'AO e l’avanzamento della gravità della malattia. Nei pazienti con DMLE la differenza di flusso volumetrico era principalmente determinata dalla riduzione del diametro dell'AO. Conseguentemente alla riduzione del calibro e del flusso volumetrico è stato rilevato un aumento della velocità del flusso sanguigno all’interno di entrambi i vasi e un aumento della resistenza al flusso nell’AO nei soggetti affetti da DMLE rispetto ai controlli sani; quest’ultimo risultato, a livello dell’ACI, è stato individuato solo nei pazienti con malattia in fase intermedia.
Inoltre, in tre soggetti aventi la forma umida in un occhio e la forma secca nel controlaterale è stato riscontrato che il flusso volumetrico dell’AO nel lato della forma umida era ridotto di almeno 1.6mL/min rispetto a quello del lato con la forma secca intermedia.
Un possibile limite di questo studio potrebbe essere il non aver riportato se questi pazienti siano stati sottoposti a valutazione cardiovascolare poiché l’esito di tale indagine avrebbe potuto rivelare non soltanto che i controlli non erano affetti da DMLE ma che potrebbero anche aver avuto un rischio cardiovascolare inferiore. Questo avrebbe comportato un carico aterosclerotico minore e di conseguenza diametri di AO più elevati e flussi di volume più alti, quindi una migliore perfusione coroideale (13). Gli autori hanno inoltre riferito di due pazienti che avevano solo un occhio colpito dalla malattia. Sarebbe interessante sapere se la tendenza alla riduzione del flusso volumetrico AO sia stata osservata pure nell'occhio non affetto di tali pazienti. Questa evidenza, anche se priva di significatività statistica, aiuterebbe a capire se i cambiamenti vascolari si verificano prima o dopo lo sviluppo della patologia. Oltretutto, la differenza in termini di flusso volumetrico AO tra due occhi dello stesso paziente, uno affetto da DMLE e l'altro sano, potrebbe suggerire la fattibilità dell'angioplastica AO di cui si parlerà nel prossimo paragrafo (14).
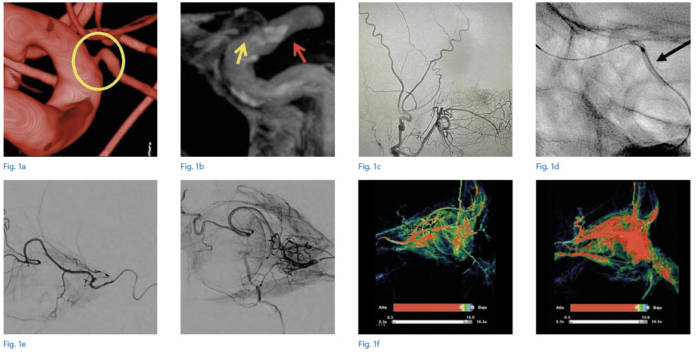
Possibili risvolti terapeutici: l’angioplastica dell’arteria oftalmica
Un elemento da considerare è la presenza di patologie cardiovascolari che portano a una riduzione del flusso sanguigno all’interno dell’ACI causando conseguentemente una riduzione della perfusione dell’AO. Uno studio condotto da Lylyk et al. ha provato a dimostrare come, intervenendo sulla perfusione dell’arteria oftalmica, si possa migliorare l’andamento della maculopatia. È stata eseguita quindi un’angioplastica dell’AO stenotica in cinque pazienti con concomitante DMLE a uno stadio avanzato in uno o entrambi gli occhi. Lo studio ha riscontrato un miglioramento dell’acuità visiva (circa tre linee) statisticamente significativo che rimaneva stabile per sei mesi. I risultati sono stati incoraggianti, con significativi (seppur lontani dal totale ripristino visivo) miglioramenti della visione in quattro pazienti su cinque. È stata inoltre provata la fattibilità e la sicurezza della procedura di stenting dell’arteria oftalmica, considerato che attualmente non esistono cateteri intravascolari designati specificatamente per questo vaso il quale, oltre ad avere un lume ridotto, origina ad angolo acuto dall’ACI (15).
È stato dunque dimostrato che esiste un'associazione tra DMLE e cambiamenti vascolari a monte dell’occhio e come sia possibile migliorare la perfusione retinica attraverso lo stenting dell’arteria oftalmica
Conclusioni
È stato dunque dimostrato che esiste un'associazione tra DMLE e cambiamenti vascolari a monte dell’occhio e come sia possibile migliorare la perfusione retinica attraverso lo stenting dell’arteria oftalmica, intervenendo quindi sulla patogenesi della malattia. Tuttavia, queste indagini sono soltanto preliminari in quanto sarebbero necessari ulteriori studi su un maggior numero di pazienti, lo sviluppo di strumenti adatti allo stenting dell’AO e una migliore scelta dei soggetti includendo anche valutazioni a livello cardiovascolare in modo da evitare eventuali bias di selezione.
Bibliografia
1. Ling Wong W, Su X, Li X, et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet Glob Heal 2014;2:e106–16 CrossRef Medline
2. Ratnapriya R, Chew EY. Age-related macular degeneration-clinical review and genetics update. Clin Genet 2013;84:160–16 CrossRef Medline
3. Ferris FL, Wilkinson CP, Bird A, et al. Clinical classification of agerelated macular degeneration. Ophthalmology 2013;120:844–51 CrossRef Medline
4. Ratnapriya R, Chew EY. Age‐related macular degeneration—clinical review and genetics update. Clin Genet 2013;84:160–6.
5. Blasiak J, Petrovski G, Veréb Z, et al. Oxidative stress, hypoxia, and autophagy in the neovascular processes of age-related macular degeneration. Biomed Res Int 2014;2014:1–7.
6. Kaarniranta K, Salminen A, Eskelinen E-L, et al. Heat shock proteins as gatekeepers of proteolytic pathways—Implications for age-related macular degeneration (AMD). Ageing Res Rev 2009;8:128–39.
7. Chakravarthy U, Wong TY, Fletcher A, et al. Clinical risk factors for age-related macular degeneration: a systematic review and meta-analysis. BMC Ophthalmol 2010;10:31.
8. Pennington KL, DeAngelis MM. Epidemiology of age-related macular degeneration (AMD): associations with cardiovascular disease phenotypes and lipid factors. Eye Vis (London) 2016;3:34.
9. Boltz A, Luksch A, Wimpissinger B, et al. Choroidal blood flow and progression of age-related macular degeneration in the fellow eye in patients with unilateral choroidal neovascularization. Invest Ophthalmol Vis Sci 2010;51:4220–25 CrossRef Medline
10. Dai W, O’Loughlin L, Yu G, et al. Arterial spin labeling measured choroidal blood flow is reduced in age-related macular degeneration and correlates with severity level. Proc Intl Soc Mag Reson Med 2016;24:1416
11. Metelitsina TI, Grunwald JE, DuPont JC, et al. Foveolar choroidal circulation and choroidal neovascularization in age-related macular degeneration. Invest Ophthalmol Vis Sci 2008;49:358–63 CrossRefMedline
12. Grunwald JE, Metelitsina TI, DuPont JC, et al. Reduced foveolar choroidal blood flow in eyes with increasing AMD severity. Invest Ophthalmol Vis Sci 2005;46:1033–38 CrossRef Medline
13. Mitu O, Crisan A, Redwood S, et al. The Relationship between Cardiovascular Risk Scores and Several Markers of Subclinical Atherosclerosis in an Asymptomatic Population. J Clin Med 2021;10(5):1–12.
14. Hibert ML, Chen YI, Ohringer N, Feuer WJ, Waheed NK, Heier JS, Calhoun MW, Rosenfeld PJ, Polimeni JR. Altered Blood Flow in the Ophthalmic and Internal Carotid Arteries in Patients with Age-Related Macular Degeneration Measured Using Noncontrast MR Angiography at 7T. AJNR Am J Neuroradiol. 2021 Sep;42(9):1653-1660. doi: 10.3174/ajnr.A7187. Epub 2021 Jul 1. PMID: 34210664; PMCID: PMC8423057.
15. Lylyk I, Bleise C, Lylyk PN, Perez N, Lundquist J, Scrivano E, Francone AA, Charles M, Zompa T, Lylyk P. Ophthalmic artery angioplasty for age-related macular degeneration. J Neurointerv Surg. 2022 Jan 5:neurintsurg-2021-018222. doi: 10.1136/neurintsurg-2021-018222. Epub ahead of print. PMID: 34987072.







