Il glaucoma è un gruppo di neuropatie ottiche caratterizzate dalla perdita progressiva e irreversibile di cellule ganglionari retiniche e dal conseguente danno al campo visivo. Con oltre 70 milioni di persone affette, il glaucoma è tutt’oggi la prima causa al mondo di cecità irreversibile.
Le stime prevedono inoltre un aumento del numero di pazienti glaucomatosi, superiore a 110 milioni entro il 2040, perlopiù in Asia e Africa (1). Ad oggi, la pressione intraoculare (PIO) rimane il più importante fattore di rischio modificabile per ridurre l’insorgenza o la progressione del danno glaucomatoso.
La riduzione della PIO può essere conseguita mediante un approccio farmacologico, laser, o chirurgico.
In una quota di pazienti, la terapia medica e quella laser non sono sufficienti a ridurre la PIO a valori soddisfacenti per rallentare la progressione della malattia, oppure sono gravate da troppi effetti collaterali, rendendo necessario valutare l’opzione chirurgica.
Tradizionalmente, l’obiettivo della chirurgia del glaucoma consiste nell’oltrepassare le naturali vie di deflusso dell’umor acqueo per creare una via di scarico esterna nello spazio sottocongiuntivale.
I due approcci tradizionali consistono nella trabeculectomia e nell’impianto di valvole drenanti.
Sebbene efficaci, entrambi gli approcci sono gravati da un rischio non indifferente di sviluppo di complicanze pericolose per la vista o di necessità di re-intervento (fino all’1% per i dispositivi drenanti e fino al 7% per la trabeculectomia) (2).
La necessità di nuovi approcci chirurgici che fossero al contempo sicuri ed efficaci ha portato allo sviluppo nell’ultimo decennio di nuovi strumenti chiamati nel loro complesso MIGS, Minimally Invasive Glaucoma Surgery.
Le caratteristiche che tradizionalmente definiscono i MIGS sono le seguenti:
- approccio chirurgico ab-interno – con alcune eccezioni - attraverso microincisioni il meno traumatiche possibile e risparmio della congiuntiva;
- efficacia soddisfacente nel ridurre la PIO;
- sicurezza elevata, in particolare minor rischio di ipotono postoperatorio rispetto agli approcci chirurgici tradizionali;
- rapido tempo di recupero per il paziente.
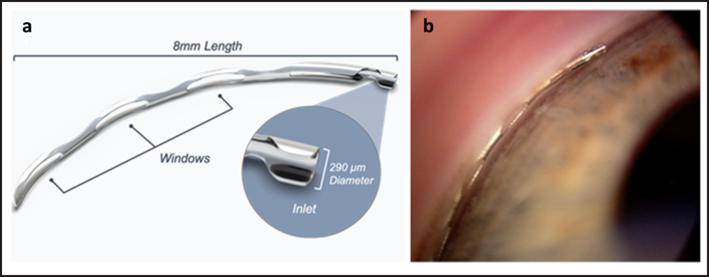
Fig. 2B Dispositivo Hydrus (eandv.biomedcentral.com/articles/10.1186/s40662-019-0157-y).
Nel corso dell’ultimo decennio l’utilizzo dei MIGS è diventato un paradigma del trattamento chirurgico del glaucoma e ha permesso di proporre trattamenti più specifici per le esigenze di ciascun paziente.
Le varie tecniche MIGS disponibili vengono classificate sia in base alla sede anatomica di impianto sia in base al sistema di riduzione della PIO:
- MIGS che mettono in comunicazione diretta la camera anteriore e il canale di Schlemm sfruttando la via convenzionale di deflusso dell’umor acqueo;
- MIGS che mettono in comunicazione la camera anteriore con lo spazio sovracoroideale sfruttando la via uveosclerale;
- MIGS che mettono in comunicazione la camera anteriore con lo spazio sottocongiuntivale creando una via di filtrazione esterna (attraverso un approccio ab-interno o ab-externo).
MIGS del canale di Schlemm
Il razionale fisiopatologico comune a questo gruppo di device consiste nel bypassare la resistenza al deflusso dell’umore acqueo fornita dal trabecolato. Sono state ideate varie strategie, riassumibili principalmente come microstent, microincisioni e viscocanaloplastica.
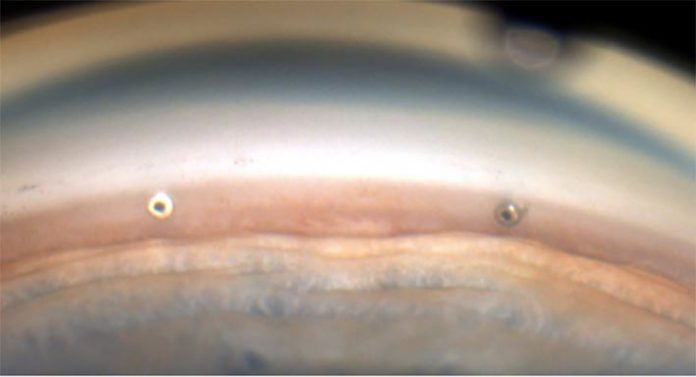
I microstent mirano a superare la resistenza del trabecolato permettendo il deflusso dell’umore acqueo direttamente nel canale di Schlemm. Ne sono stati sviluppati diversi: il primo ad essere commercializzato è stato l’iStent (Glaukos Corp., San Clemente, CA, USA), al quale è seguita una seconda generazione, l’iStent Inject. La prima generazione era un sistema a singolo stent.
Tuttavia, alcuni studi hanno suggerito che stent multipli, raggiungendo una più ampia area del canale di Schlemm, potrebbero avere maggiore efficacia rispetto a un singolo stent, non essendo invece così rilevante per il deflusso dell’acqueo la differenza in termini di dimensioni e diametro del lume.
Per tale motivo la seconda generazione prevede un sistema a due stent, con dimensioni del singolo stent ridotte rispetto al precedente.
Un altro microstent disponibile è l’Hydrus (Ivantis, Inc., Irvine, CA, USA), device che con i suoi 8 mm di lunghezza raggiunge circa tre ore di orologio del canale di Schlemm.
Un trial randomizzato caso-controllo che confrontava l’Hydrus con due iStent ha mostrato come i valori di IOP fossero simili nei due gruppi, mentre la prima coorte necessitava di meno farmaci ipotonizzanti ed era più frequentemente farmaco priva.
Le microincisioni nel trabecolato hanno l’obiettivo di creare una comunicazione diretta tra lo spazio della camera anteriore e il canale di Schlemm. Sono effettuate mediante specifici strumenti, come il Goniotome (Neomedix Corp., Tustin, CA, USA), o procedure, come la trabeculotomia transluminale gonioscopia-assistita (GATT).
Il Goniotome consente l’escissione en bloc di una porzione di trabecolato tramite incisioni a livello dei margini anteriore e posteriore e nel primo studio di confronto tra metodiche ha mostrato una maggiore riduzione del numero di farmaci e della percentuale di IOP rispetto al gruppo di pazienti trattati con due iStent, nonostante entrambe le metodiche abbiano raggiunto valori simili di PIO.
La GATT utilizza o un microcatetere o una sutura smussa per realizzare un’incisione circonferenziale ab-interno del trabecolato su 360 gradi. Dati retrospettivi sull’outcome a lungo termine hanno dimostrato una efficacia continua nella larga maggioranza dei pazienti.
La viscocanaloplastica prevede la distensione e l’allargamento del canale di Schlemm, dei canali collettori distali e dell’adiacente trabecolato iuxtacanalicolare. Attualmente può essere portata a termine tramite la canaloplastica ab-interno (ABiC) o tramite la procedura OMNI (Sight Sciences, Inc., Menlo Park, CA, USA). Evidenze preliminari mostrano sicurezza ed efficacia al pari delle altre strategie incluse in questa categoria MIGS (3).
Esistono alcuni punti di debolezza comuni alle metodiche descritte che possono condurre al fallimento del trattamento. In primo luogo si è consapevoli che un certo grado di cicatrizzazione possa avvenire nella regione del trabecolato.
Inoltre vi è comunque la possibilità che alcuni pazienti abbiano resistenze al deflusso di umore acqueo distali al canale di Schlemm, riducendo quindi la potenzialità ipotonizzante di queste metodiche in questi pazienti.
MIGS dello spazio sovracoroideale
Così come i MIGS impiantati nel canale di Schlemm hanno lo scopo di favorire la via di deflusso convenzionale, i MIGS sovracoroideali sfruttano la via di deflusso uveosclerale, con una potenziale maggiore riduzione della PIO.
Il primo MIGS sovracoroideale ideato è il Cypass (Alcon), device che ha dimostrato negli studi preliminari un buon effetto di riduzione della IOP, combinato con l’estrazione di cataratta (4). Tuttavia, l’impianto Cypass è stato ritirato nel 2018, quando i dati di 5 anni di esperienza clinica hanno suggerito un incremento della perdita di cellule endoteliali corneali.
Nello specifico, a subire questo effetto erano i pazienti in cui Cypass veniva posizionato in modo più prominente nella camera anteriore, rispetto a coloro in cui rimaneva più profondo nell’angolo.
Dal momento che questo problema di posizionamento è potenzialmente risolvibile, questa evidenza non inficia totalmente la strategia degli impianti sovracoroideali.
Altri device che potenziano la via uveosclerale sono infatti in corso di sviluppo, per esempio iStent Supra (Glaukos Corporation) e MINIject (iStar Medical), rispettivamente innovativi per design dello stent e porosità del materiale di cui è composto.
Il target della via uveosclerale solleva ancora alcuni dubbi: da un lato la guarigione della ferita chirurgica attorno al device potrebbe comportarne un ridotto potere ipotonizzante, dall’altro la mancanza di un limite pressorio nella via uveosclerale rende tangibile il rischio di un ipotono clinicamente significativo.
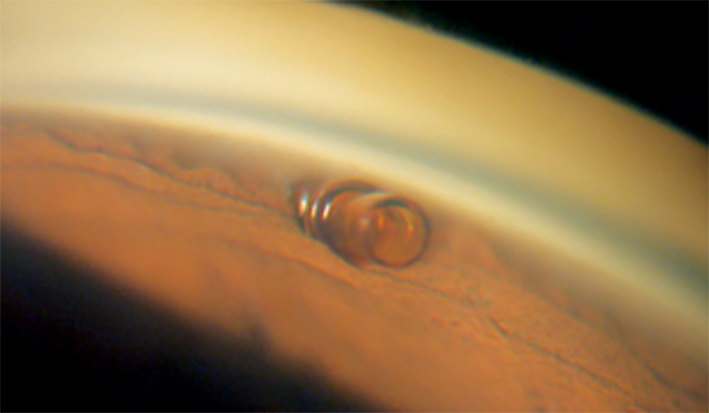
MIGS dello spazio sottocongiuntivale
A differenza delle strategie descritte finora, lo spazio sottocongiuntivale non rappresenta una fisiologica via di deflusso per l’umor acqueo.
Ogni tentativo chirurgico di creare un tragitto di deflusso nello spazio sottocongiuntivale può essere complicato da una importante risposta cicatriziale.
Tuttavia, l’uso della via sottocongiuntivale è stata a lungo il perno della chirurgia convenzionale del glaucoma. Il razionale della via sottocongiuntivale è focalizzato principalmente sulla predittività, sul controllo e sulla sicurezza di questa via.
Combinando le conoscenze ben radicate sulla guarigione delle ferite sottocongiuntivali ed episclerali, con l’avanzamento tecnologico nella fabbricazione dei dispositivi, lo spazio sottocongiuntivale offre una potente via per la riduzione della PIO.
Certamente una corretta via di deflusso sottocongiuntivale esiterà nella formazione di una bozza di filtrazione.
La metodologia per la predittività e il controllo con MIGS sottocongiuntivale si basa sulle proprietà della fluidodinamica. Come descritto da Hagen e Poiseuille, la resistenza all’efflusso è proporzionale alla lunghezza e al raggio del percorso del fluido.
Questi principi permettono ai dispositivi di avere una resistenza di efflusso intrinseca mentre al contempo permettono un precoce e immediato flusso di acqueo. Come risultato di questo principio, c’è un livello soglia di discesa della PIO, riducendo il rischio di ipotono e delle complicanze associate.
Attualmente esistono 2 tipologie di impianti che sfruttano con il loro design queste proprietà fluidodinamiche e la via di deflusso sottocongiuntivale.
Lo STENT XEN-GEL (Allergan, Inc., Irvine, CA, USA) che ha un diametro del lume interno di 45 μm ed è impiantato utilizzando un approccio ab-Interno attraverso una incisione corneale.
Quando lo stent emerge nello spazio sottocongiuntivale, per la legge di Hagen-Poiseuille la pressione di resistenza, validata sperimentalmente, è di circa 7.5 mmHg (5). L’impianto ab-interno di questo microstent elimina essenzialmente la necessità di una incisione congiuntivale con successiva sutura e quindi il rischio di deiscenza è praticamente assente.
Il dispositivo PRESERFLO (Santen Co., Japan), sfrutta alla stessa maniera le proprietà della fluidodinamica per ottenere una restrizione del flusso e quindi una maggior sicurezza.
Diversamente dallo XEN-GEL, l’impianto di questo microshunt richiede una tecnica ab-externo attraverso una incisione congiuntivale con dissezione e creazione di un tunnel sclerale, il vantaggio teorico risiede nel design e nel materiale utilizzato (6).
Nello specifico, il PRESERFLO è composto da un materiale inerte e biocompatibile noto come SIBS.
Dal momento che la guarigione episclerale e la cicatrizzazione sono il maggior fattore di rischio nel fallimento della chirurgia, ogni tentativo di mitigare questa reazione può aumentare il successo, come avviene già nella chirurgia tradizionale con l’uso di agenti antimitotici. Sono tuttavia necessari studi per validare il razionale nell’impianto di questo dispositivo.
Conclusioni
La terapia chirurgica del glaucoma sta crescendo notevolmente negli ultimi anni e nuovi approcci per una chirurgia ipotonizzante continuano a susseguirsi.
Con un panorama così ampio gli specialisti potrebbero cadere vittime dell’indecisione al momento della scelta del trattamento adeguato da proporre al singolo paziente.
Il primo step per procedere ad una decisione è l’identificazione di biomarkers, basati sulle caratteristiche del paziente e della patologia in questione, che possano aiutare a personalizzare la proposta terapeutica.
Per esempio, l’uso di una tecnica basata sul canale di Schlemm potrebbe risultare poco vantaggiosa in un caso di glaucoma indotto da corticosteroidi, condizione in cui è primariamente il trabecolato ad essere compromesso.
A tal proposito, sono ancora necessari studi clinici randomizzati per identificare con maggiore evidenza i relativi pro e contro di ogni MIGS in gruppi selezionati di pazienti con caratteristiche peculiari (7).
Per concludere, come sa bene chi si occupa di glaucoma, la scarsa aderenza al trattamento costituisce uno dei principali ostacoli alla terapia medica ipotonizzante: grazie all’avvento dei MIGS e di farmaci a lento rilascio, questo problema potrebbe essere ridimensionato, migliorando la qualità delle cure e favorendo il raggiungimento del comune obiettivo dell’alleanza terapeutica, ovvero la salute del paziente.
Gli autori dichiarano di non avere alcun conflitto di interessi.
- Tham YC, Li X, Wong TY, Quigley HA, Aung T, Cheng CY. Global prevalence of glaucoma and projections of glaucoma burden through 2040: a systematic review and meta-analysis. Ophthalmology. 2014;121(11):2081–90.
- Gedde SJ, Feuer WJ, Shi W, Lim KS, Barton K, Goyal S, et al. Treatment outcomes in the primary tube versus trabeculectomy study after 1 year of follow-up. Ophthalmology. 2018;125(5):650–63.
- Grover DS, Smith O, Fellman RL, Godfrey DG, Gupta A, Montes de Oca I, et al. Gonioscopy-assisted transluminal trabeculotomy: An ab interno circumferential trabeculotomy: 24 months follow-up. J Glaucoma. 2018;27 (5):393–40
- Hoeh H, Ahmed II, Grisanti S, Grabner G, Nguyen QH, et al. Early postoperative safety and surgical outcomes after implantation of a suprachoroidal micro-stent for the treatment of open-angle glaucoma concomitant with cataract surgery. J Cataract Refract Surg. 2013;39(3):431-7
- Sheybani A, Reitsamer H, Ahmed II. Fluid dynamics of a novel micro-fistula implant for the surgical treatment of glaucoma. Invest Ophthalmol Vis Sci. 2015;56(8):4789–95.
- Shah, M. Micro-invasive glaucoma surgery – an interventional glaucoma revolution. Eye and Vis 6, 29 (2019).
- Kevin Kaplowitz, Igor I. Bussel, Nils A. Loewen. Minimally Invasive and Microincisional Glaucoma Surgeries. Yanoff and Duker Ophthalmology 5th edition. 2019