Il diabete mellito con 382 milioni di affetti in tutto il mondo è considerato la pandemia del XXI secolo e secondo le proiezioni dell’Organizzazione Mondiale della Sanità il numero di casi raddoppierà entro il 2035 (1).
In Italia, il numero di individui affetti da diabete mellito è di circa 3,5 milioni, pari al 5,5% della popolazione, e ha registrato un incremento del 60% negli ultimi 20 anni (2). La retinopatia diabetica rimane una delle prime cause di deficit visivo in età lavorativa nei paesi industrializzati e può raggiungere gli stadi più avanzati e gravi nella pressoché totale assenza di sintomi. La sua prevalenza è di circa il 70% nei pazienti con diabete tipo 1 (DMT1) e del 40% fra quelli con diabete tipo 2 (DMT2), senza differenze di genere (3). La scala di severità dell’International clinical diabetic retinopathy (ICDR) attualmente utilizzata nella pratica clinica riconosce 5 diversi gradi di severità (4):
- no retinopatia diabetica
- retinopatia diabetica non proliferante lieve
- retinopatia diabetica non proliferante moderata
- retinopatia diabetica non proliferante severa
- retinopatia diabetica proliferante.
Si parla di retinopatia diabetica non proliferante (RDNP) o proliferante (RDP) a seconda della presenza o meno di nuovi vasi, con diversi stadi di gravità e quindi di rischio di complicazioni, che possono portare fino alla cecità. In presenza di RDP, l’ischemia retinica è causa di una incongrua risposta neovascolare, con la crescita di capillari neoformati dai vasi venosi della papilla del nervo ottico e/o della retina periferica. I neovasi tendono a crescere sulla superficie retinica e a invadere il corpo vitreo. Poiché molto fragili, possono sanguinare facilmente dando luogo a emorragie pre-retiniche, se comprese fra corpo vitreo e retina, oppure a emorragie vitreali (emovitreo) che possono essere causa di cecità improvvisa, ancorché limitata nel tempo al periodo necessario al riassorbimento dell’emorragia stessa. I neovasi e le emorragie sono seguiti dallo sviluppo di tessuto fibroso di sostegno alla vascolarizzazione patologica stessa che, originando dal piano retinico e contraendosi, può dare luogo a distacco di retina trazionale (DRT), con grave ipovisus o cecità non emendabile. In presenza di RDP complicata da DRT non esiste ad oggi terapia diversa da quella chirurgica, mediante intervento di vitrectomia pars plana (VPP). Le complicanze intra operatorie e peri-operatorie di questa chirurgia sono notevolmente ridotte oggi rispetto al passato grazie al continuo avanzamento tecnologico (5,6) (strumenti di calibro sempre più piccolo per accessi chirurgici minimali, migliorate performance tecniche e velocità di taglio). L’emovitreo è una complicanza della RDP riportata nel 46% e nel 48% degli occhi nell’arco di 5 anni nonostante il trattamento con fotocoagulazione (7,8). La vitrectomia è stata il trattamento standard sin dagli anni ‘70, per l’emovitreo non responsivo a osservazione con riassorbimento spontaneo (9). Negli anni recenti, l’approccio terapeutico dell’emovitreo ha subito delle modifiche nel “timing” e nelle modalità terapeutiche, verso terapie non chirurgiche che hanno ridotto i rischi comunque presenti nell’atto chirurgico. La cura dell’emovitreo, infatti, si può avvalere anche delle IVT di anti-VEGF che inducono la regressione della neovascolarizzazione, riducendo il rischio di sanguinamento e stabilizzando verso la fibrosi la NV (10).
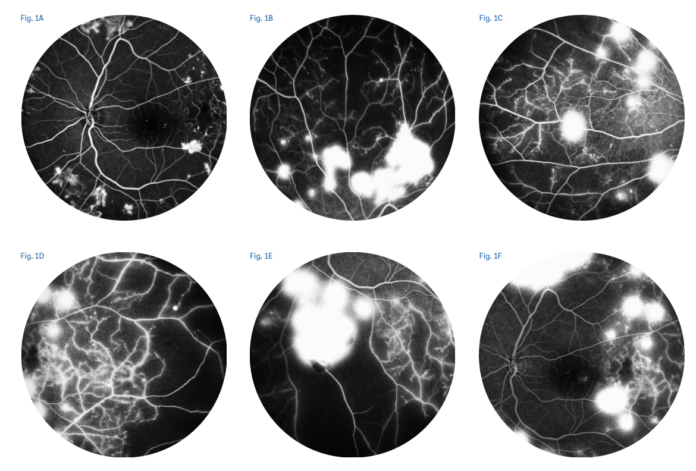
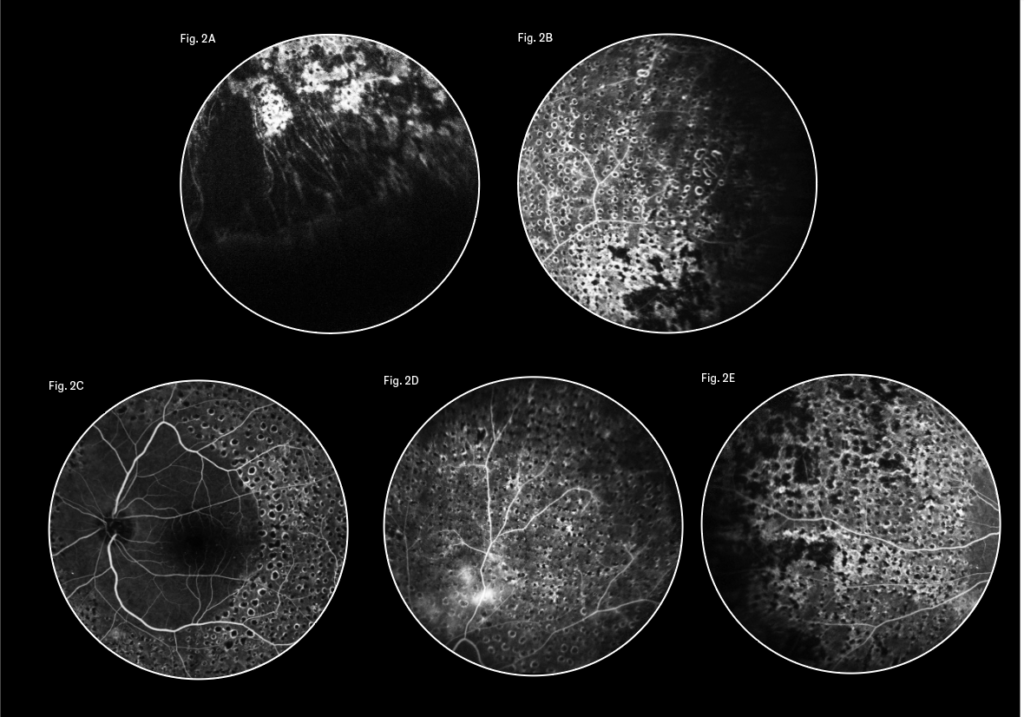
Il corretto approccio terapeutico dell’emovitreo tuttavia, ancora oggi, deve essere guidato da un attento esame del paziente mediante un imaging diagnostico multimodale, senza tralasciare importanti informazioni provenienti dalla sua storia clinica oculare pregressa al fine di decidere quali tra i possibili scenari terapeutici, cioè l’attesa, IVT di anti-VEGF o la vitrectomia sia il più indicato. In presenza di emovitreo è fondamentale eseguire l’esame del fondo oculare per valutare il grado di densità dell’emovitreo: variabile dal grado 1 con una minima emorragia vitreale in cui sia il disco ottico che i vasi retinici sono ben esplorabili, al grado IV in cui l'emorragia vitreale è massiva e densa tanto da non consentire la visualizzazione di nessun particolare del fondo oculare (11). Va ricercata inoltre alla lampada a fessura l’eventuale presenza di rubeosis iridea (segno di severità della RDP). Utili sono anche le informazioni provenienti dall’integrazione delle immagini ottenute con l’ecografia A-Scan e B-Scan che diventano esami indispensabili in presenza di opacità dei mezzi diottrici. L'ecografia B-Scan, infatti, fornisce informazioni con immediatezza riguardo a morfologia, topografia e localizzazione delle eventuali lesioni proliferative nonché all'evolutività dell’emovitreo (lesioni puntiformi iperiflettenti in camera vitrea se l’emovitreo è recente o lesioni membranose se non recente), dei rapporti tra vitreo e retina per eventuali compresenti aderenze, trazioni e/o distacco di retina. L’ecografia A-Scan, invece, permette la diagnosi differenziale tra membrane neoformate e retina. Non va mai dimenticata la raccolta dell’anamnesi oculare remota che consente di risalire a pregressa terapia laser o si possono valutare pregressi esami diagnostici (come la fluorangiografia) per avere informazioni sullo stato di severità della retinopatia diabetica e il pregresso trattamento laser. Dalla integrazione di tutte queste informazioni è spesso possibile valutare il grado di severità che insieme alla compliance del paziente, cioè alla sua capacità di rispettare i controlli programmati e lo stretto follow-up, nonché allo stato dell’occhio adelfo, condizionano le scelte terapeutiche e il timing chirurgico. Infatti, in caso di emovitreo in RDP in parte già trattata da fotocoagulazione laser in assenza di membrane neoformate o distacco di retina ecograficamente accertato, l’approccio può essere non chirurgico ma medico, mediante l’uso di IVT di farmaci anti-VEGF e monitoraggio mensile così da completare, appena la trasparenza del vitreo lo consente, il trattamento laser panfotocoagulativo ancora oggi considerato terapia gold standard per la RDP (figure 1-3). Le iniezioni intravitreali di anti-VEGF non inducono di per sé il riassorbimento dell’emovitreo ma favoriscono la regressione dei neovasi e impediscono il nuovo sanguinamento, facilitando il riassorbimento del sangue presente in camera vitrea grazie anche alla induzione di fenomeni di sineresi vitreale e talvolta una separazione della ialoidea posteriore che facilita la clearance dell’emorragia vitreale stessa (12). Le IVT di farmaci anti-VEGF offrono il vantaggio di eliminare i rischi correlati all’intervento di vitrectomia a svantaggio di un recupero visivo più lento nel tempo, pertanto l’utilizzo di tale terapia è condizionato dall’attività lavorativa del paziente (necessità di rapido recupero visivo), dallo stato dell’occhio controlaterale e dalla sua compliance (capacità di rispettare i controlli per un follow-up più lungo). Tale approccio conservativo è stato validato da numerosi studi pubblicati in letteratura (13). In particolare, uno studio prospettico randomizzato del DRCR network (14) ha confrontato i risultati visivi dopo 24 settimane dell’emovitreo in RDP trattato solo con aflibercept rispetto al trattamento con vitrectomia e fotocoagulazione panretinica, mostrando la non inferiorità del trattamento conservativo rispetto alla chirurgia. È importante infatti sottolineare che, in caso di inadeguato follow-up e trattamento, il rischio di progressione verso forme più gravi di RDP complicate da distacco di retina trazionale è altissimo, con grave perdita della funzione visiva: nello stesso studio il 22% dei pazienti persi al follow-up nel braccio trattato con IVT di anti-VEGF ha sviluppato un distacco di retina trazionale (14). I vantaggi di una vitrectomia precoce o “early” in caso di RDP con emovitreo anche di severità moderata sono la risoluzione rapida dell’emorragia e quindi il rapido recupero dell’acuità visiva, nonché la possibilità di rimuovere chirurgicamente le trazioni sui ciuffi di neovasi, e di completare intraoperatoriamente la PRP (15). L’intervento chirurgico di PPV rimane comunque oggi l’unico approccio terapeutico in presenza di emorragia vitreale densa che non si riassorbe dopo un follow-up di 4 settimane di attesa, sotto stretto monitoraggio ecografico che permetta di identificare eventuali modifiche del quadro clinico (es. la comparsa di un distacco di retina) che impongono di procedere all’intervento di VPP urgente (10).
Negli ultimi anni, tuttavia, sta cambiando anche l’approccio terapeutico nei riguardi della retinopatia diabetica proliferante non complicata da emovitreo, grazie all’avvento dei farmaci anti-VEGF (14) da un lato e la continua evoluzione della tecnica chirurgica e delle vitrectomie dall’altro (15). La terapia laser con PRP è ancora oggi il gold standard di terapia della RDP, in quanto capace di indurre la completa risoluzione dei neovasi al disco ottico e sulla retina rispetto all’osservazione. La sua efficacia veniva sancita nel lontano 1991 poiché il laser era in grado di ridurre dal 60% a meno del 5% l’incidenza di cecità 5 anni dopo la comparsa della retinopatia proliferante e di un terzo il decremento dell’acuità visiva nell’edema maculare con lo svantaggio di indurre restringimento del campo visivo, deterioramento della visione notturna e la comparsa di edema maculare cistoide indotte dal laser (16,17). Il protocollo S del DRCR (18) ha dimostrato la non inferiorità del trattamento con IVT di farmaci anti-VEGF rispetto alla PRP per il trattamento della RDP con una migliore acuità visiva finale. Tale trattamento ha il vantaggio di proteggere dall’insorgenza dell’edema maculare e non indurre danni del campo visivo ma il suo successo richiede una alta capacità di collaborazione da parte del paziente che dovrà sottoporsi a visite di monitoraggio che consentano di rilevare la necessità di ritrattamento con IVT alla ricomparsa dei neovasi. Nello stesso protocollo S (19), infatti, veniva suggerito di sottoporre a tale terapia solo pazienti disposti a sottoporsi a follow-up continui per l’elevata percentuale di evoluzione in forme severa di RDP con DR trazionale nei pazienti persi al follow-up (12). La comunità scientifica, pertanto, è consapevole che l'abbandono delle cure sia un rischio grave nei pazienti con RDP e raccomanda di adattare l’approccio al trattamento in base alle esigenze del paziente (figure 1-3).
Con lo sviluppo di sistemi per microincisione, visione grandangolare, visualizzazione 3D e OCT intraoperatoria, e le tecniche bimanuali, la VPP viene utilizzata su una gamma più ampia di indicazioni rispetto al passato inclusa la RDP in assenza di DRT “early vitrectomy” fino ad oggi trattata con anti-VEGF e PRP (15).
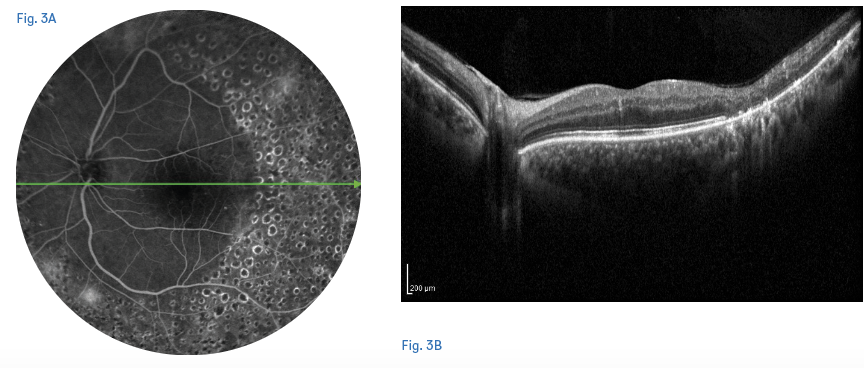
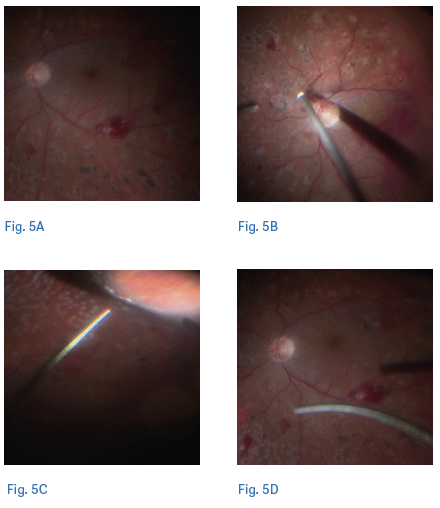
La early VPP trova il razionale in quanto trattamento capace di stabilizzare il quadro clinico a lungo termine mediante l’atto chirurgico così da ridurre la necessita di follow-up di monitoraggio più stringenti. La scelta dell’early vitrectomy è influenzata dalla assenza di distacco posteriore di vitreo (DPV), infatti la VPP consente intraoperatoriamente l’induzione del DPV e la rimozione del vitreo che rappresenta lo scaffold fibrotico su cui potrebbe svilupparsi la neovascolarizzazione, prevenendo così il distacco di retina trazionale. Inoltre, la VPP ha il vantaggio di rimuovere il tessuto fibrovascolare esistente ed eseguire il trattamento PRP (15,20) (figure 4,5).
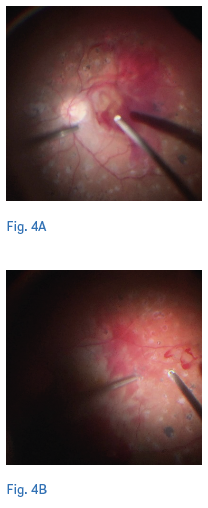
La scelta di utilizzare la early VPP nasce dalla consapevolezza che le complicanze correlate alla terapia chirurgica sono oggi notevolmente ridotte grazie all’utilizzo di strumenti di calibro sempre più piccolo (23, 25, e 27 gauge) che consentono una vitrectomia “suturless” pur mantenendo una elevata manovrabilità all’interno dell’occhio per il miglioramento della rigidità degli strumenti. Inoltre, le nuove vitrectomie hanno aumentato il numero dei tagli e migliorato la fluidità, così da consentire un’aspirazione efficiente e un taglio preciso con minore trazione sulla retina e un migliore accesso al piano tissutale, così da essere utilizzati sia come pinza che pick o forbice, grazie alla ridotta distanza porta-superficie (21,22). In aggiunta, l’utilizzo dei coloranti (23,24) del vitreo consente un’attenta rimozione dei residui di corticale vitreale adesi alla retina, nonché la possibilità, a fine intervento, di utilizzare anti-VEGF o i cortisonici per prevenire una recidiva di sanguinamento nel postoperatorio e ridurre l’infiammazione (24). Altro vantaggio non trascurabile della “early PPV” è la possibilità di completare la PRP intraoperatoria consentendo così al paziente di ridurre gli accessi in ospedale rispetto alla terapia con PRP e anti-VEGF, apportando così anche un vantaggio economico per il sistema sanitario (15). È facilmente intuibile come la riduzione del numero di iniezioni, in un contesto sanitario saturo di terapie intravitreali per diverse forme di maculopatia, caratterizzato da elevati tempi di attesa e da una impossibilità di accesso alle cure da parte di molti pazienti, possa avere un impatto sicuramente positivo non solo dal punto di vista economico, ma anche prettamente organizzativo. Non si può tuttavia, nella scelta terapeutica individualizzata, non tenere conto delle complicanze di ciascun atto terapeutico e di conseguenze delle complicanze intra e perioperatorie con la VPP che, sebbene ridotte rispetto al passato, sono ancora più importanti rispetto alle altre terapie menzionate.
Liao e Wang (25), infatti, valutando le differenti complicanze, sottolineano che l’incidenza di glaucoma neovascolare e sclerosi del cristallino è nettamente superiore al gruppo di pazienti trattati PPV rispetto alle IVT di farmaci anti VEGF e la PRP. La VPP precoce a fronte delle maggiori complicanze in definitiva è certamente una possibile terapia che trova indicazione in forme gravi di RDP che richiedono un intervento rapido in tempi brevi e di pazienti che non sono in grado di rispettare la necessità sottoporsi a stretto follow-up di monitoraggio.
In conclusione, per il trattamento della RDP esistono oggi più possibiltà terapeutiche (PRP, IVT anti VEGF, Early PPV) senza che vi sia una linea guida condivisa. Certamente la terapia è individualizzata per ogni singolo paziente e deve tenere conto delle severità della RDP, dell’età e della compliance del paziente, del compenso glicometabolico e dello stato dell’occhio adelfo senza mai sottovalutare e minimizzare i rischi intra e postoperatori della early VPP (26).
Gli autori dichiarano l’assenza di conflitti di interesse.