Le neovascolarizzazioni coroideali (CNV) possono essere associate a diverse condizioni morbose, tra cui alcune relativamente comuni come la degenerazione maculare legata all’età (DMLE), la miopia patologica, la corioretinopatia sierosa centrale. In queste patologie il trigger iniziale sembra essere una sofferenza dell’epitelio pigmentato retinico e/o della membrana di Bruch.
Le aree colpite dal ridotto apporto di ossigeno attivano fattori di trascrizione come HIF-1 (Hypoxia-Inducible Factor-1), capaci di causare la sintesi di VEGF (Vascular Endothelial Growth Factor), cui segue la formazione di neovasi immaturi, fragili, predisposti all’essudazione e alla rottura.
La produzione di VEGF accompagna anche le infiammazioni oculari: possibile insorgenza di CNV. In questo caso il VEGF è indotto sia da uno stimolo ipossico, come visto sopra, oppure da IFN, molecola centrale nelle cascate molecolari infiammatorie e dosato in grandi quantità nell’umor acqueo e nel vitreo durante alcune uveiti.
Nonostante ciò, le CNV in infiammazioni oculari da cause non infettive sono eventi piuttosto rari (rischio cumulativo in 2 anni del 2.7%). La loro identificazione è cruciale per una corretta diagnosi, vista la diversa gestione e prognosi rispetto a condizioni degenerative come la DMLE.
Le CNV infiammatorie (iCNV) si localizzano tipicamente tra retina ed epitelio pigmentato retinico (EPR), e sono quindi considerate “classiche” secondo classificazione fluorangiografica e “type 2” secondo classificazione OCT.
Presentiamo le principali cause di iCNV infettive e non infettive.
iCNV infettive
Cause infettive di CNV infiammatorie sono toxoplasmosi, POHS, tubercolosi intraoculare, tra le altre. Sono forme molto rare e l’esatta prevalenza è difficile da stabilire.
La corioretinite da toxoplasma gondii è l’uveite posteriore infettiva più diffusa al mondo, con maggior prevalenza nell’asia meridionale.
Le CNV in questa patologia hanno una frequenza approssimativa dello 0.3% - 19%, tendono ad insorgere attorno alle cicatrici di lesioni pregresse, anche a distanza di anni dall’evento acuto, e si associano a cisti intra o subretiniche e ad emorragie.
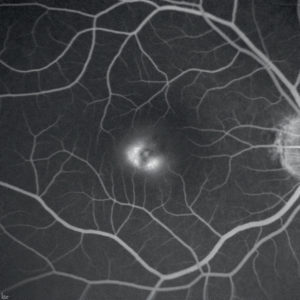
La POHS (Presumed Ocular Histoplasmosis Syndrome) è una sindrome causata dall’infezione sistemica da histoplasma capsulatum, fungo dimorfico presente soprattutto in aree occidentali, e rappresenta una delle principali cause di perdita di vista irreversibile in pazienti in età adulta. La triade classica è: atrofia peripapillare, cicatrice atrofiche, assenza di vitreite.
Le CNV sono complicanze quasi sempre presenti (92%) e tendono a localizzarsi attorno a cicatrici ed al di sopra dell’EPR. All’esame del fundus, le neovascolarizzazioni attive appaiono come lesioni simil-disciformi, grigio-verdastre, circondate da un bordo pigmentato.
La tubercolosi (TBC) intraoculare, decisamente variabile nella sua manifestazione, vede come pattern patologico più comune l’uveite posteriore, la quale può essere complicata, in alcuni casi, da CNV. I neovasi insorgono intorno ai granulomi coroideali, caratteristicamente ipocianescenti all’ICGA, e si localizzano al di sopra (più di frequente, type 2 CNV), o al di sotto (type 1 CNV) dell’EPR.
iCNV non infettive
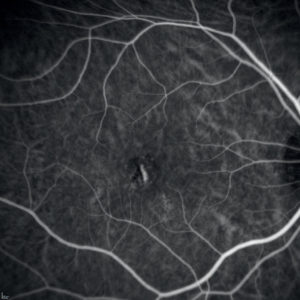
Le neovascolarizzazioni coroideali in patologie infiammatorie non infettive sono più comuni e per questo esistono più dati a riguardo.La multifocal choroiditis (MFC) e la punctate inner choroidopathy (PIC) fanno parte del cluster delle “white dot syndromes”, un eterogeneo gruppo di patologie idiopatiche caratterizzate dalla presenza di lesioni bianco-giallastre di origine infiammatoria che colpiscono la retina esterna, l’EPR e la coroide.
Nonostante alcuni autori tendano a tenere ben separate queste ultime due patologie, a nostro modo di vedere è più utile raggrupparle, per la significativa sovrapposizione demografica e clinica. Tipicamente queste condizioni interessano donne giovani, in salute e moderatamente miopi.
Le due principali complicanze sono la fibrosi sottoretinica e la neovascolarizzazione coroideale.
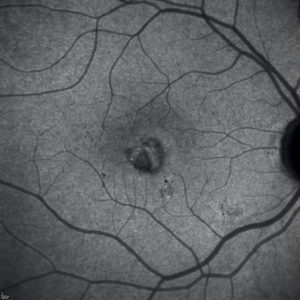 Quest’ultima complicanza interessa fino al 60% dei casi di MFC/PIC e si associa ad una peggiore prognosi visiva.
Quest’ultima complicanza interessa fino al 60% dei casi di MFC/PIC e si associa ad una peggiore prognosi visiva.
Nonostante la difficoltà nel differenziare una lesione infiammatoria da una CNV, è fondamentale riconoscere prontamente la complicanza neovascolare, data la presenza di un trattamento efficace disponibile.
La serpiginous choroiditis è una rara infiammazione oculare idiopatica. È bilaterale, cronica e progressivamente coinvolge la retina esterna, l’EPR, la coriocapillare e i vasi della coroide. Colpisce pazienti in salute, tra i 30 e i 70 anni, più comunemente di sesso maschile. Tale patologia è caratterizzata da numerosi eventi acuti che si susseguono sottoforma di edema infiammatorio della retina esterna con più o meno evidente distacco del neuroepitelio. La fine di ogni evento acuto, ottenuta naturalmente o grazie al trattamento, si associa ad atrofia dell’EPR e della coriocapillare. Queste lesioni tendono ad estendersi centrifugamente assumendo un aspetto di “estroflessioni”.
Il centro, appunto, può essere la zona peripapillare, nella forma più comune, o la regione maculare nella variante a minore prevalenza. Le CNV complicano questa patologia nel 13-20% e si localizzano più di frequente vicino alle lesioni nelle aree peripapillari, sottofoveali o extrafoveali. È opportuno ricercare l’eventuale presenza di neovasi, intervenendo con la giusta terapia per evitare lesioni cicatriziali permanenti.
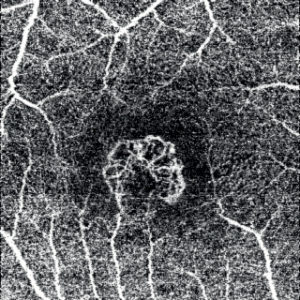
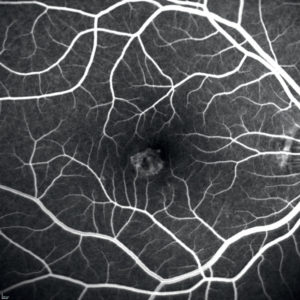
OCTA: scansione ottenuta a livello degli strati retinici esterni che mette in evidenza il network neovascolare.
Diagnosi
È importante tenere in considerazione la causa uveitica/infiammatoria nella diagnosi differenziale delle neovascolarizzazioni coroideali, soprattutto in presenza di classici segni infiammatori (cellule in camera anteriore, vitreite) o in assenza di quelli degenerativi in corso di DMLE (drusen, ipo-/iperpigmentazione dell’EPR). Può essere una diagnosi difficile in pazienti con segni di miopia patologica e CNV (tipicamente type 2 nel miope).
Dal punto di vista clinico, le iCNV a livello foveale possono manifestarsi con la comparsa di metamorfopsie, calo del visus, scotomi in un paziente spesso già noto per uveite, o con segni di uveite. Le neovascolarizzazioni infiammatorie a localizzazione extrafoveale rappresentano a volte un riscontro casuale nel follow-up di un paziente uveitico.
Il quadro oftalmoscopico del paziente con iCNV può comprendere aree grigiastre con anello di pigmento, espressione della CNV, così come lesioni infiammatorie corioretiniche ed esiti cicatriziali delle stesse, emorragie ed essudazione. Le iCNV atrofiche, dall’aspetto giallastro, possono presentare aree di fibrosi e alterata pigmentazione.
L’aspetto fluorangiografico delle iCNV è quello di CNV classiche, cioè lesioni iso/iperfluorescenti nelle fasi precoci associate a leakage tardivo. La presenza del leakage è spesso di ostacolo nella diagnosi differenziale con le lesioni infiammatorie non neovascolari, che appaiono generalmente iso/ipofluorescenti in fase precoce, e si associano in fase tardiva a leakage (se in fase attiva di malattia) o a staining (se atrofiche).
L’ICGA può completare il quadro diagnostico, aiutando a identificare la presenza di iCNV, in particolare con componente occulta, e di alterazioni coroideali, come le aree ipocianescenti di coroidite.
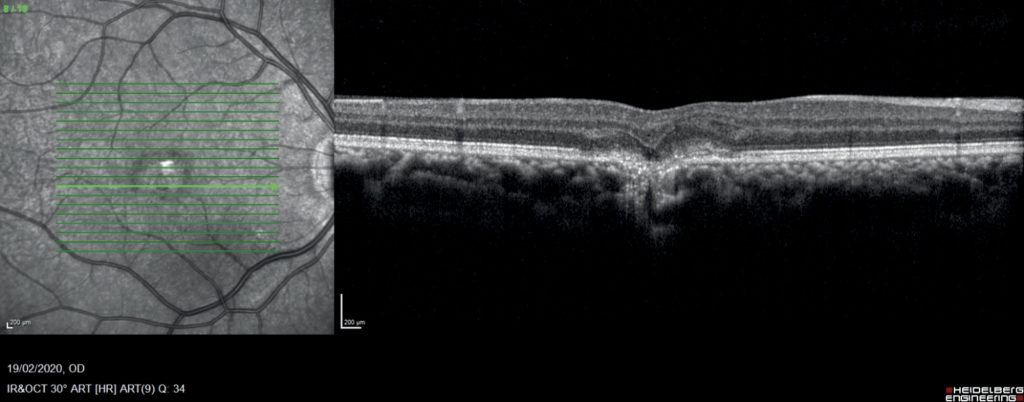
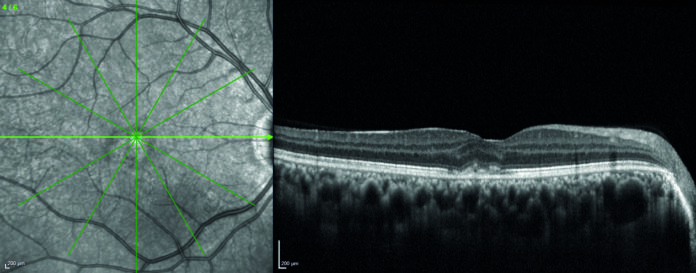
OCT: nello stesso occhio delle immagini precedenti è visibile il caratteristico “V-sign”, descritto da Zhang et al. nel IV stadio della PIC, causato dalla regressione atrofica della lesione infiammatoria [19].
Lo spessore centrale della retina è talvolta utilizzato come misura indicativa, ma oggettivabile, dell’attività delle CNV infiammatorie.
Un tratto distintivo osservato in CNV di origine infiammatoria è il “pitchfork sign” (segno della forca). Questo segno, descritto da Hoang et al, è rappresentato da estroflessioni digitiformi iperriflettenti che si estendono dall’area della CNV agli strati retinici esterni.
Così come per l’esame fluorangiografico, anche lo studio OCT riconosce un elemento di criticità nell’interpretare talune lesioni come espressione della malattia di base (lesioni corioretiniche infiammatorie) o come l’insorgenza di una complicanza neovascolare (iCNV).
Una caratteristica distintiva, osservabile per esempio in immagini OCT di coroidite multifocale, è l’aumento della penetrazione del segnale al di sotto di lesioni corrispondenti a foci infiammatori, segno di norma assente nelle CNV.
L’OCT enhanced depth (EDI) permette lo studio della coroide e delle modificazioni del suo spessore. Attraverso questa metodica è stato osservato che nelle iCNV lo spessore coroideale sotto la CNV aumenta in fase attiva, per tornare normale dopo il trattamento. Questo fenomeno, recentemente definito da Giuffré et al “sponge sign” (segno della spugna), non è stato invece individuato in pazienti con CNV miopica attiva, in cui lo spessore coroideale non subisce modificazioni significative.
L’OCTA (optical coherence tomography angiography) è un’evoluzione della tecnologia OCT che consente, pur con alcuni limiti, l’identificazione del flusso all’interno dei neovasi, analizzando le differenze tra scansioni OCT acquisite a brevissimi intervalli.
L’esame OCTA può agevolare la diagnosi nei casi in cui le altre modalità di imaging non abbiano permesso di acclarare la presenza di una neovascolarizzazione. Con questa metodica le iCNV appaiono sul piano coronale come un gomitolo di vasi a livello degli strati retinici esterni e dell’EPR; le immagini in B-scan evidenziano in rosso il flusso della membrana neovascolare.
In definitiva, l’approccio multimodale è di sicuro vantaggio nella diagnosi di una CNV di origine infiammatoria.
Terapia
Per una serie di motivi (non ultimi la relativa rarità della condizione in questione e il profilo eterogeneo dei pazienti) non esistono delle rigorose linee guida a cui il clinico può attenersi nella terapia. In ragione di tale incertezza, gli attuali capisaldi terapeutici sono due: iniezioni intravitreali di anti-VEGF, per agire sulla componente neovascolare, e steroidi (sistemici, subtenoniani o intravitreali), per spegnere la componente infiammatoria. Alternative possibili, cui tuttavia si riconosce un ruolo principalmente secondario a trattamenti citati, includono gli agenti immunosoppressivi, sistemici o intravitreali, e la terapia fotodinamica (PDT), utilizzata soprattutto in passato.
Gli anti-VEGF sono molecole che, bersagliando il VEGF, agiscono su due aspetti cruciali: la permeabilità vascolare e l’angiogenesi. Sebbene manchino ampi trial clinici randomizzati, vi sono numerosi case reports e case series che documentano l’efficacia di questi agenti in una pluralità di entità uveitiche, infettive e non.
Tra le condizioni infiammatorie infettive, esistono evidenze circa l’efficacia di questi farmaci (in termini di miglioramento dell’acuità visiva) nel trattamento delle CNV insorte in toxoplasmosi oculare, POHS e TBC oculare.
Tra le condizioni infiammatorie non infettive che si sono dimostrate responsive al trattamento vanno citate la MFC e la coroidite serpiginosa.
Il razionale all’utilizzo degli steroidi risiede non solo nella loro attività antinfiammatoria, ma anche nella loro interferenza con gli effetti del VEGF, prodotto in grandi quantità in corso di eventi flogistici.
Nell’era pre-antiVEGF, la prima linea nella terapia delle CNV infiammatorie era rappresentata dai corticosteroidi orali ad alte dosi, approccio che conduceva ad una stabilizzazione del visus in più dell’80% dei pazienti.
Da studi successivi condotti mettendo a confronto alte dosi di steroidi sistemici con singole iniezioni di steroidi sotto-tenoniani è emersa una sostanziale equivalenza in termini di stabilizzazione dell’acuità visiva a lungo termine, così come si sono ottenuti risultati incoraggianti con le iniezioni intravitreali di triamcinolone acetonide in pazienti con CNV da POHS.
Nonostante l’efficacia, le iniezioni di triamcinolone acetonide sono una scelta terapeutica ormai poco praticata a causa dell’alto rischio di ipertensione oculare. Ad oggi, non esistono evidenze sull’utilizzo di impianti intravitreali a lento rilascio di desametasone.
Più recentemente è stata descritta, in un lavoro retrospettivo su 29 pazienti, la maggiore efficacia della tripla terapia - steroide sistemico per os, anti- VEGF e terapia immunosoppressiva per os (micofenolato mofetile o ciclosporina) – iniziata prontamente alla diagnosi della CNV, rispetto all’aggiunta “on demand” dell’immunosoppressore nei casi di scarsa risposta.
La scelta più frequente ricade sulla combinazione tra steroide sistemico per os e iniezione intravitreale di anti-VEGF. Va peraltro notato che la terapia delle CNV infiammatorie richiede generalmente un numero di iniezioni inferiore rispetto a patologie più comuni come la DMLE.
Bibliografia
1.
Mammadzada, P., Corredoira, P.M. & André, H. The role of hypoxia-inducible factors in neovascular age-related macular degeneration: a gene therapy perspective. Cell. Mol. Life Sci. 77, 819–833 (2020)
2.
Ahn JK, Yu HG, Chung H, Park YG. Intraocular cytokine environment in active Behcet uveitis. Am J Ophthalmol (2006)
3.
Baxter, Sally L. et al. Risk of Choroidal Neovascularization among the Uveitides. American Journal of Ophthalmology, Volume 156, Issue 3, 468 - 477.e2 (2003)
4.
Holland, Gary N. Ocular toxoplasmosis: a global reassessment. American Journal of Ophthalmology, Volume 136, Issue 6, 973 – 988 (2013)
5.
Neri, P., Mercanti, L., Mariotti, C. et al. Long-term control of choroidal neovascularization in quiescent congenital toxoplasma retinochoroiditis with photodynamic therapy: 4-year results. Int Ophthalmol 30, 51–56 (2010)
6.
Saperstein, David A et al. Photodynamic therapy of subfoveal choroidal neovascularization with verteporfin in the ocular histoplasmosis syndrome. Ophthalmology, Volume 109, Issue 8, 1499 – 1505 (2002)
7.
Agarwal, A., Invernizzi, A., Singh, R.B. et al. An update on inflammatory choroidal neovascularization: epidemiology, multimodal imaging, and management. J Ophthal Inflamm Infect 8, 13 (2018)
8.
Invernizzi, A., Agarwal, A., Di Nicola, M., Franzetti, F., Staurenghi, G., & Viola, F. (2018). Choroidal neovascular membranes secondary to intraocular tuberculosis misdiagnosed as neovascular age-related macular degeneration. European Journal of Ophthalmology, 28(2), 216–224. (2018)
9.
Gilbert, Rose M. et al. Differentiating Multifocal Choroiditis and Punctate Inner Choroidopathy: A Cluster Analysis Approach. American Journal of Ophthalmology, Volume 213, 244 – 251 (2020)
10.
Essex RW, Wong J, Fraser-Bell S, et al. Punctate Inner Choroidopathy: Clinical Features and Outcomes. Arch Ophthalmol. 2010;128(8):982–987. (2010)
11.
Ahmed AH, Kubaisi B, Foster CS. Serpiginous Choroiditis. JAMA Ophthalmol. 2017;135(4):e165495.
12.
Dolz-Marco R, Fine H, Freund K. How to Differentiate Myopic Choroidal Neovascularization, Idiopathic Multifocal Choroiditis, and Punctate Inner Choroidopathy Using Clinical and Multimodal Imaging Findings. Ophthalmic Surg Lasers Imaging Retina. 2017; 48: 196-201.
13.
Ahnood, Dana et al. Punctate inner choroidopathy: A review
Survey of Ophthalmology, Volume 62, Issue 2, 113 – 126 (2017)
14.
Fine HF, Zhitomirsky I, Freund KB et al (2009) Bevacizumab and ranibizumab for choroidal neovascularization in multifocal choroiditis. Retina (Philadelphia, Pa) 29(1):8–12 (2009)
15.
Christmas NJ, Oh KT, Oh DM, Folk JC Long-term follow-up of patients with serpinginous choroiditis. Retina (Philadelphia, Pa) 22(5):550–556 (2002)
16.
Hoang QV, Cunningham ET, Sorenson J, Freund KB The "pitchfork sign" a distinctive optical coherence tomography finding in inflammatory choroidal neovascularization. Retina. 2013 May;33(5):1049-55. (2013)
17.
Giuffrè C, Marchese A, Fogliato G, Miserocchi E, Modorati G, Sacconi R, Cicinelli MV, Miere A, Amoroso F, Capuano V, Souied E, Bandello F, Querques G. The “Sponge sign”: a novel feature of inflammatory choroidal neovascularization Eur J Ophthalmol (2020) [in pubblicazione]
18.
P. Neri, F. Pichi, V. Pirani & I. Arapi: Systemic Immunosuppression Is Highly Effective in the Long-term Control of Inflammatory non-infectious Uveitic Choroidal Neovascularization: A Comparative Study. Ocular Immunology and Inflammation (2020)
19.
Zhang, Xiongze et al. Spectral-Domain Optical Coherence Tomographic Findings at Each Stage of Punctate Inner Choroidopathy Ophthalmology, Volume 120, Issue 12, 2678 – 2683 (2013)