Durante la fase REM del sonno, chiamato anche “sonno paradosso”, ossia quando stiamo sognando, è osservabile all’elettroencefalogramma (EEG) un’intensa attività elettrica cerebrale simile allo stato di veglia, ma con l’assenza di tono muscolare volontario (atonia), fatta eccezione per i muscoli extraoculari che danno origine ai cosiddetti Rapid Eyes Moviments.
Per quale motivo l’organismo dovrebbe consumare energia per generare questi movimenti oculari rapidi? Quale spiegazione scientifica può essere attribuita ad un fenomeno apparentemente inutile?
Fino ad oggi i ricercatori hanno elaborato due ipotesi per spiegare questo fenomeno: si tratterebbe di segni aspecifici di attivazione del tronco encefalico oppure gli occhi seguirebbero le immagini durante la fase onirica del sonno.
Analogie bulbo oculare e cervello
Dal punto di vista embriologico, il bulbo oculare ed il nervo ottico hanno origine da una estroflessione diencefalica. L’occhio infatti ha diverse analogie con il cervello. Esso è avvolto da 3 membrane: la sclera, le trabecole dello spazio sopracoroideale e la coroide che corrispondono rispettivamente alla dura madre, all’aracnoide ed alla pia madre del cervello.
Una parte della coroide, detta corpo ciliare, produce umor acqueo ed alcuni componenti dell’umor vitreo, esattamente come nei ventricoli dell’encefalo analoghe strutture, chiamate plessi coroidei, producono liquido cefalorachidiano.
Le cellule dei corpi ciliari e dei plessi coroidei esprimono inoltre sulla loro membrana le medesime acquaporine (AQP1), canali proteici che permettono il flusso bi-direzionale di acqua.
I seni venosi durali dell’encefalo corrispondono al canale sclerale di Schlemm.
Esiste una barriera ematoencefalica così come una ematoretinica e il circolo arterioso è in entrambi i casi di tipo terminale.
Infine il cervello e la retina possiedono una doppia rete vascolare: superficiale e profonda.
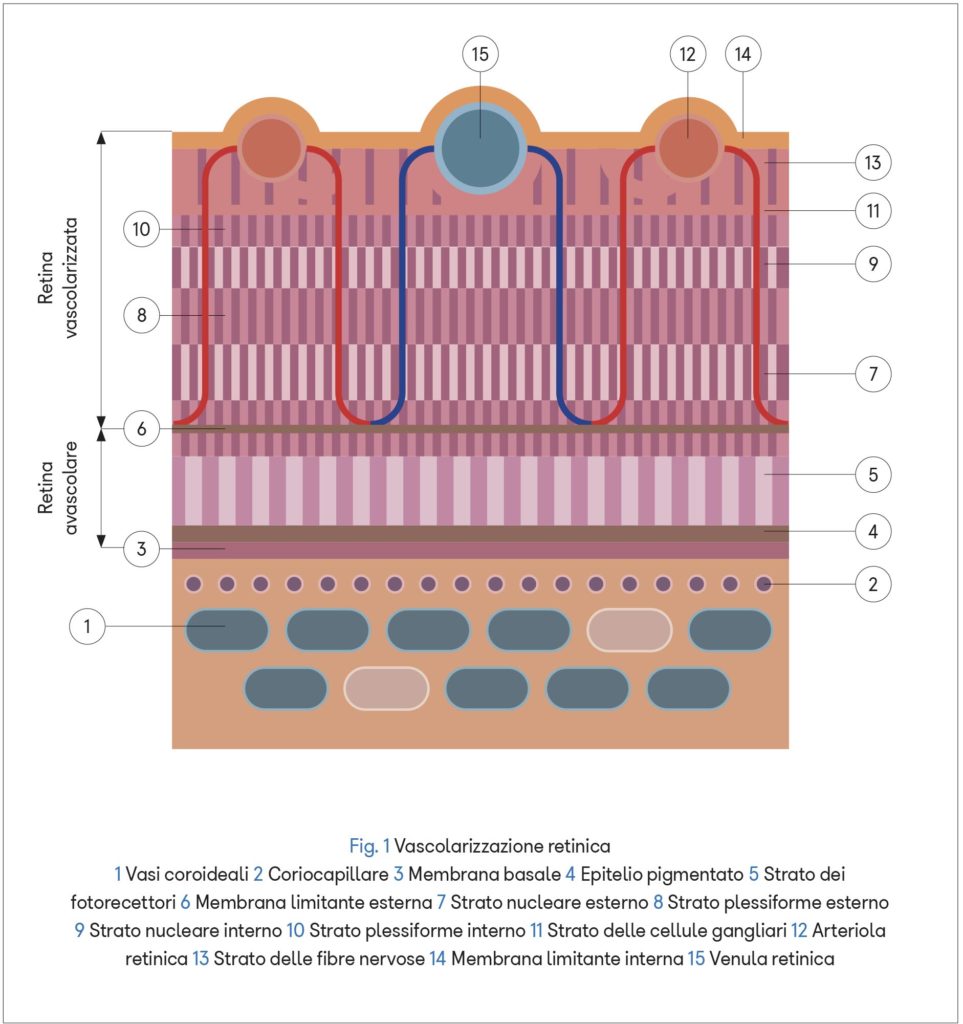
Vascolarizzazione retina e nervo ottico
La vascolarizzazione della retina dipende dal complesso vascolare dell’arteria centrale della retina costituito da due plessi, uno superficiale ed uno profondo, in comunicazione tra loro, che irrora la retina interna compresa tra le fibre nervose ganglionari e lo strato plessiforme esterno.
La retina più esterna (strato dei fotorecettori ed epitelio pigmentato) non possiede vasi sanguigni propri e viene nutrita dal liquido interstiziale proveniente dalla sottostante circolazione coroideale.
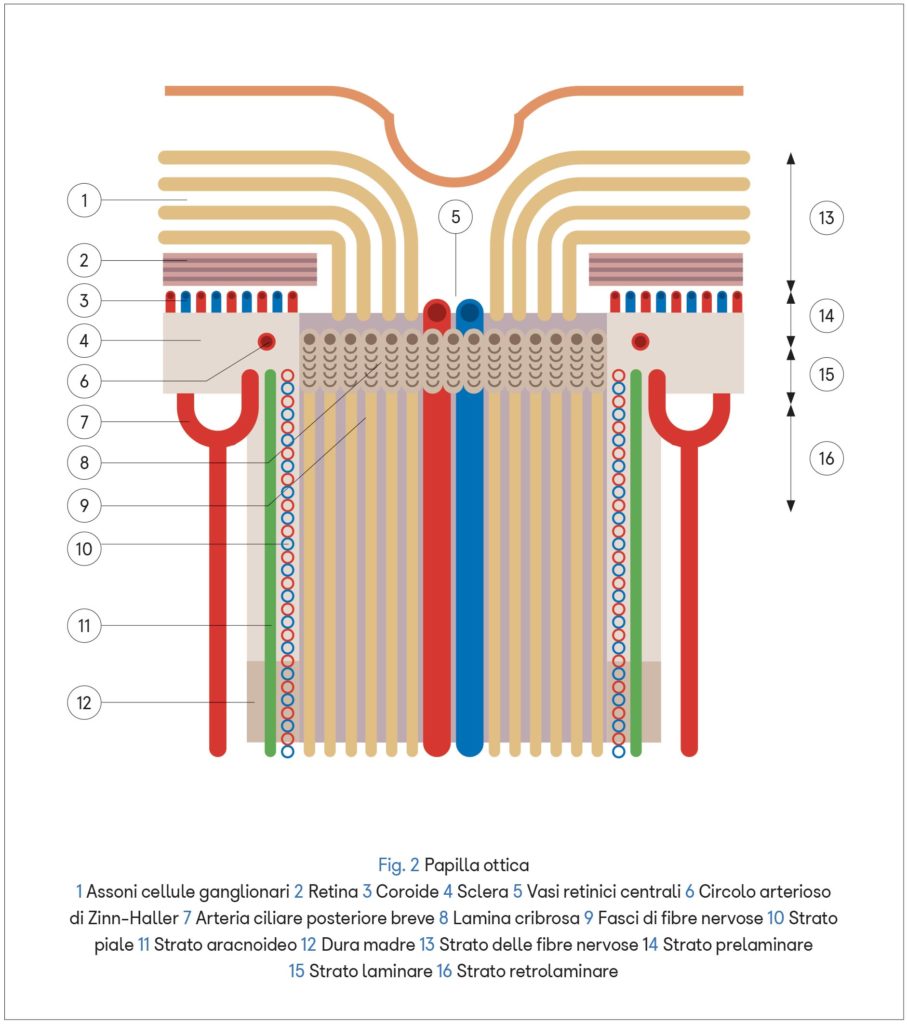
Il nervo ottico invece, avvolto dalle tre meningi encefaliche, è vascolarizzato da rami dell’arteria oftalmica: le arterie ciliari posteriori e le arterie piali.
All’interno della papilla ottica si trova la lamina cribrosa, una membrana elastica costituita da fasci di fibre provenienti dalla sclera, frammiste ad astrociti, che si incrociano a livello dell’orifizio del nervo ottico e formano piccoli fori attraverso i quali passano gli assoni delle cellule ganglionari.
La presenza della lamina cribrosa crea un gradiente di pressione tra i fluidi dello spazio intraoculare (con pressione maggiore) e il liquor dello spazio retrobulbare intracranico (con pressione minore) influenzando i flussi assoplasmatici anterogrado e retrogrado. Grazie al flusso anterogrado la cellula nervosa trasporta i metaboliti (enzimi, neurotrasmettitori, vescicole, segmenti strutturali di neurotubuli e neurofilamenti) dal corpo cellulare alla periferia, mentre quello retrogrado conduce i cataboliti da eliminare o riciclare nella direzione opposta.
Eliminazione delle scorie cerebrali: il sistema glinfatico
Come nel cervello, i neuroni della retina e del nervo ottico hanno un’intensa attività metabolica, soprattutto al polo posteriore, consumano molta energia (ATP) e producono molte scorie come ad esempio β-amiloide.
Tutti i tessuti eliminano le scorie attraverso i vasi linfatici. Le pareti di questi vasi non hanno cellule muscolari, sono dotati di valvole interne che grazie alla contrazione delle arterie e dei muscoli, permettono lo scorrimento unidirezionale della linfa.
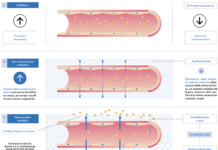
Il cervello, la retina ed il nervo ottico sono però sprovvisti di vasi linfatici! Sappiamo che il liquido cefalorachidiano, attraverso un processo di diffusione passiva, svolge un ruolo importante nella eliminazione delle scorie e nell’apporto di nutrienti ai tessuti cerebrali. JJ Iliff e M. Nedergaard dell’Università di Rochester hanno pubblicato nel 2012 uno studio condotto sul cervello dei topi, funzionalmente simile a quello umano, che evidenzia la presenza di un altro sistema di eliminazione dei cataboliti più veloce ed efficiente. Utilizzando molecole traccianti e tecniche di microscopia elettronica bifotonica, sono riusciti a dimostrare che il liquor subaracnoideo entra nel parenchima cerebrale attraverso dei canali para-arteriosi costituiti dalle acquaporine (AQP4) presenti sui piedi terminali degli astrociti. Grazie alle pulsazioni delle arterie questo sistema, definito “glinfatico”, genera una “pompa cerebrale” che spinge il liquor attraverso gli spazi interstiziali per rimuovere le scorie, quindi si raccoglie in canali para-venosi per essere eliminato attraverso le granulazioni aracnoidee ed i vasi linfatici meningei giungendo fino al circolo venoso (1,2,3,4). Nel 2015 A. Louveau dell’Università della Virginia ha infatti dimostrato nei topi la presenza di vasi linfatici che avvolgono i seni venosi della dura madre, connessi ai linfonodi cervicali profondi (3), riprendendo ciò che l’anatomista P. Mascagni intuì nel diciottesimo secolo. È stata inoltre dimostrata, da Aspelund e colleghi di Helsinki, la connessione tra sistema glinfatico e vasi linfatici meningei (5).
Durante le fasi più profonde del sonno (NREM), è stato evidenziato che il sistema glinfatico sarebbe dieci volte più attivo, il liquido cefalorachidiano aumenterebbe del 60% negli spazi interstiziali e quindi verrebbe eliminata una quantità maggiore di scorie (7).
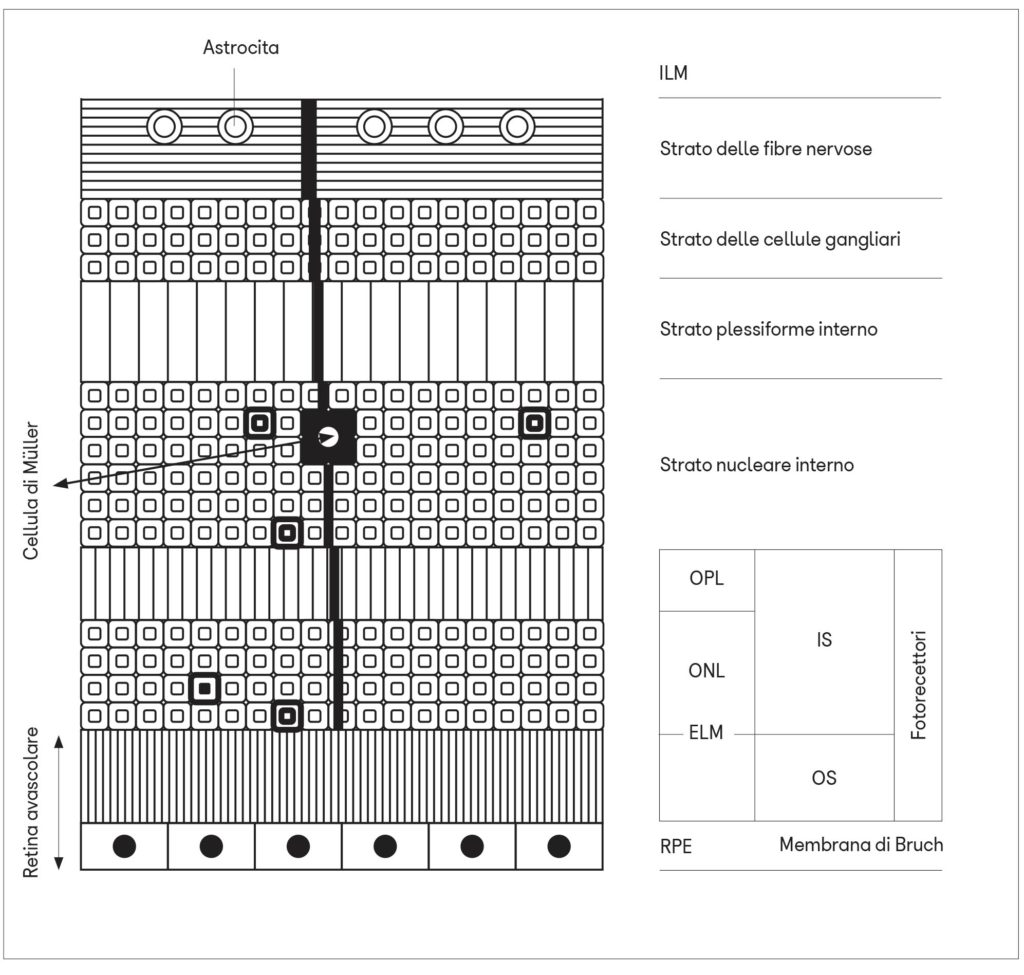
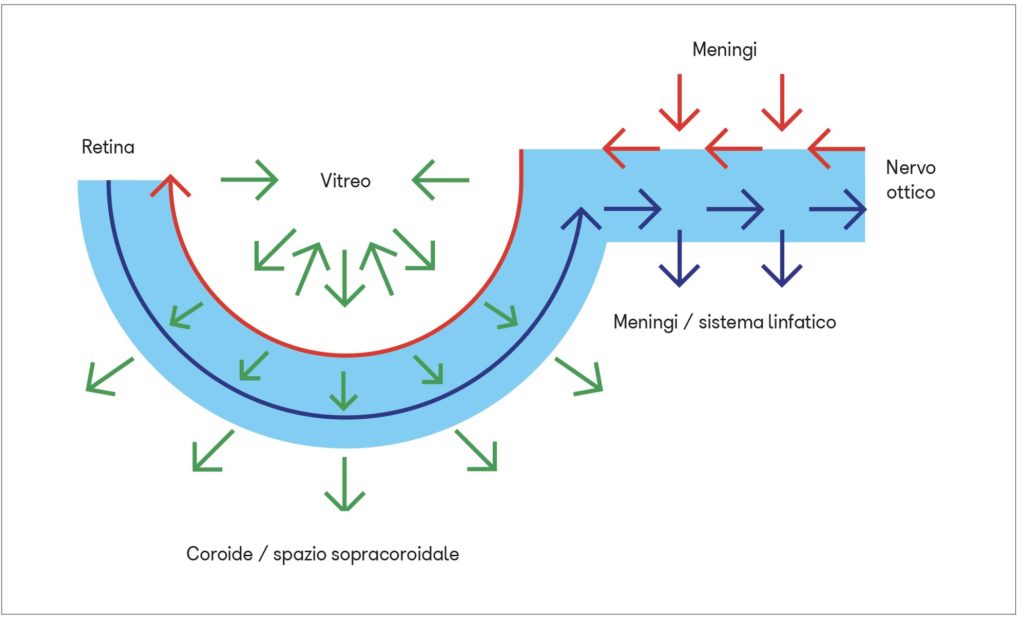
È verosimile che anche nella retina e nel nervo ottico possa esistere un sistema glinfatico?
Il sistema glinfatico può svolgere la propria funzione a livello del nervo ottico retrolaminare grazie alla presenza dei vasi piali e del liquor proveniente dalle meningi (6).
Nella retina, invece, questo sistema sarebbe rappresentato dagli astrociti che decorrono in colonne parallelamente agli assoni delle cellule ganglionari retiniche e dalle cellule di Müller che si estendono in profondità perpendicolarmente alla superficie della retina costituendo, con le loro estremità ramificate, la membrana limitante interna ed esterna. Queste membrane impacchettano tutti gli strati cellulari del neuroepitelio tranne i segmenti esterni dei fotorecettori e l’epitelio pigmentato.
L’alterazione del ritmo sonno/veglia e in particolare della fase onirica
del sonno potrebbe contribuire a pregiudicare l’azione della pompa vitreale,
della matrice extracellulare e del sistema glinfatico,
favorendo l’insorgenza della degenerazione maculare e del glaucoma
Sulla membrana delle loro terminazioni sono presenti numerose acquaporine (AQP4) che sono espresse anche sulle cellule dell’epitelio pigmentato. Entrambe queste cellule gliali avvolgono a manicotto i vasi retinici e sfrutterebbero la contrazione arteriosa per drenare i liquidi interstiziali.
Nel tratto vascolarizzato compreso tra gli assoni ganglionari prelaminari e lo strato plessiforme esterno, il sistema glinfatico può quindi esistere grazie alla presenza degli astrociti e delle cellule di Müller. Questo sistema verrebbe però a mancare negli strati retinici più esterni (fotorecettori ed epitelio pigmentato) dove non vi sono vasi sanguigni. Questa è la sede in cui si svolgono importanti processi biochimici (fototrasduzione, fagocitosi e rigenerazione dei segmenti esterni dei fotorecettori, trasporto di sostanze nutritive, secrezione di molecole), viene consumata molta energia e si producono molte scorie che se non venissero eliminate potrebbero dare origine alla degenerazione maculare. Come sarebbe allora possibile eliminare le scorie dalla retina esterna avascolare?
La funzione della pompa vitreale
La matrice extracellulare è la componente amorfa, acellulare del tessuto connettivo e rappresenta un sistema funzionale in cui tutte le cellule dei tessuti possono aderire, migrare, proliferare, modificare la loro forma e funzione. Essa è costituita da acqua, glicosamminoglicani (GAG) e proteine fibrose, ma soprattutto segue un ritmo circadiano trasformandosi da uno stato viscoso di gel ad uno fluido di sol e viceversa.
Nel fondo oculare la matrice extracellulare è ben rappresentata dall’umor vitreo, dalle lamine basali (presenti nella lamina cribrosa, nelle membrane limitante interna ed esterna e nella membrana di Bruch), dallo spazio intercellulare retinico e dalla matrice interfotorecettoriale che mantiene l’adesione tra i segmenti esterni dei fotorecettori e l’epitelio pigmentato.
Infine è importante ricordare che il corpo vitreo è fisiologicamente adeso alla regione maculare ed alla papilla ottica.
Durante la veglia il corpo vitreo subisce degli spostamenti all’interno del bulbo oculare, generati dai movimenti della testa, dai muscoli extraoculari e dall’accomodazione del cristallino, che esercitano una pressione positiva e negativa a livello della superficie retinica e della lamina cribrosa.
Insieme alle contrazioni delle arterie retiniche, questa “pompa vitreale” contribuirebbe al movimento dei fluidi interstiziali e ad aumentarne il flusso dalla lamina cribrosa allo strato plessiforme esterno e viceversa attraverso gli spazi paravenosi. La pompa vitreale permetterebbe soprattutto il drenaggio delle scorie dagli strati non vascolarizzati della retina, spingendo il fluido interstiziale attraverso le cellule di Müller e l’epitelio pigmentato fino nelle lacune linfatiche della coroide e quindi nello spazio sovracoroideale analogo a quello subaracnoideo delle meningi encefaliche.
Se quanto sopra esposto fosse verosimile, la degenerazione maculare ed il glaucoma avrebbero in comune alcuni meccanismi patogenetici. Nel glaucoma, inoltre, l’ipertono concomitante potrebbe determinare lo sfiancamento e l’arretramento della lamina cribrosa che perderebbe elasticità rendendo meno efficace l’azione della pompa vitreale.
Poiché il flusso di una corrente è maggiore al centro, la zona periferica della lamina cribrosa sfiancata (dove passano le lunghe fibre assonali provenienti dalla periferia retinica temporale) sarebbe la prima ad essere interessata dalla disfunzione della pompa come infatti accade nelle prime fasi della malattia glaucomatosa.
Ciò spiegherebbe inoltre perché lo sfiancamento sclerale predisporrebbe gli occhi con miopia elevata a sviluppare il glaucoma.
Il sistema glinfatico comporta però la sottrazione di molta energia alle altre attività neuronali.
Quindi la maggior parte del processo di eliminazione dei cataboliti si svolgerebbe mentre si dorme. Infatti durante il sonno si verificherebbero le condizioni ottimali grazie alle quali la matrice extracellulare fluidifica, la fase NREM lava e la fase REM… centrifuga!
I movimenti oculari rapidi sarebbero quindi un ingegnoso meccanismo grazie al quale l’azione meccanica della “pompa vitreale” contribuirebbe ad eliminare le tossine dalla retina.
La degenerazione maculare ed il glaucoma rappresentano le due principali cause di grave perdita visiva e di cecità nella popolazione occidentale di età superiore ai 65 anni.
Nelle persone anziane possono insorgere comorbosità quali aterosclerosi, cardiopatie, diabete, calo della pressione diastolica con alterazione del ritorno venoso, riduzione della pressione intracranica, che potrebbero alterare la circolazione dei fluidi corporei. Infine invecchiando si dorme meno, meno bene e si sogna meno perché si riduce la durata della fase REM. Quindi anche l’alterazione del ritmo sonno/veglia e in particolare della fase onirica del sonno potrebbe contribuire a pregiudicare l’azione della pompa vitreale, della matrice extracellulare e del sistema glinfatico, favorendo l’insorgenza della degenerazione maculare e del glaucoma.
- Iliff JJ et al. “A paravascular pathway facilitates CSF flow through the brain parenchyma and the clearance of interstitial solutes, including amyloid β”. Science Translational Medicine 2012; 4: 147, pp 147ra 111.
- Plog BA, Nedergaard M “The Lymphatic System in CNS health and disease: past, present and future”. Ann Rev Pathol. 2018; 13: 379-394.
- Louveau A et al. “Structural and functional features of central nervous system lymphatic vessels”. Nature 2015; 523, 337-341
- Louveau A et al. “Understanding the functions and relationships of the glymphatic system and meningeal lymphatics”. J Clin Invest. 2017;127(9):3210-3219.
- Aspelund A, et al. “A dural lymphatic vascular system that drains brain interstitial fluid and macromolecules. J Exp Med. 2015;212(7):991-999.
- Wostyn P, Van Dam D, et al. “A new glaucoma hypothesis: a role of glymphatic system dysfunction”. Fluids Barriers CNS. 2015; 12: 16.
- Xie L et al. “Sleep drives metabolite clearance from the adult brain” Science 2013; 342 (6156).