L'edema maculare diabetico (EMD) rappresenta una delle complicanze del diabete e una delle principali cause di cecità tra le persone in età lavorativa. Colpisce circa 7 milioni di pazienti con retinopatia diabetica (RD).
La prevalenza dell’EMD aumenta con la durata della malattia e lo stadio della RD, avvicinandosi al 30% negli adulti che hanno il diabete da più di 20 anni e nel 71% in quelli con retinopatia diabetica proliferante (1-3).
Il meccanismo eziopatogenetico dell’EMD appare complesso. La componente infiammatoria gioca un ruolo fondamentale nel suo sviluppo. Alla base del meccanismo fisiopatologico della RD esiste una iperproduzione di radicali liberi dell’ossigeno, implicati nel fenomeno dello stress ossidativo, che induce alterazioni morfologiche importanti e spesso irreversibili a carico dei periciti. L’iperglicemia, attraverso la glicosilazione della membrana basale delle cellule endoteliali, induce una obliterazione dei piccoli vasi oltre che alterazioni a carico delle cellule del Mϋller e delle cellule dell’epitelio pigmentato retinico (EPR). Il più importante mediatore dello sviluppo dell'EMD legato all’ipossia e rilasciato sin dai primi stadi di RD è il vascular endothelial growth factor (VEGF). Esso, infatti, induce la perdita delle tight junctions nei vasi retinici inducendo la leucostasi con conseguente difetto di perfusione capillare. Oltre al VEGF, nella RD si producono numerose altre molecole con capacità di trasmettere e amplificare il segnale di sofferenza ipossica. Tra queste molecole ci sono i metaboliti dell’acido arachidonico, il TNFα e varie interleuchine, tra cui IL1β e IL-6 (4).
Il trattamento dell’EMD appare ancora oggi di difficile gestione. Gli attuali approcci terapeutici includono il trattamento intravitreale con farmaci anti-VEGF o con steroidi associati o meno a terapia laser (5-7).
Opzioni terapeutiche e nutraceutica
Le diverse opzioni terapeutiche, ad oggi disponibili, trovano un razionale specifico all’interno della complessa patogenesi dell’EMD. Da una parte il controllo dei fattori sistemici (glicemia e pressione arteriosa) risulta fondamentale. Dall’altra, mentre i farmaci anti-VEGF hanno come target esclusivamente il VEGF, gli steroidi interferiscono con una serie più ampia di citochine, incluso il VEGF, che mediano la risposta infiammatoria.
Allo scopo di valutare l’aggiunta di diverse sostanze nel modificare le caratteristiche morfologiche e i tempi di re-iniezione dei farmaci, alcuni studi stanno valutando il ruolo della nutraceutica come possibile opzione per coadiuvare le terapie standard nelle patologie retiniche.
Numerosi sono i dati a disposizione sull’utilizzo della curcumina sul suo potenziale come agente terapeutico nelle patologie retiniche (8, 9). Molte sono le evidenze in vitro ed in vivo (modelli sperimentali) dell’attività antiossidante, antinfiammatoria e antiproliferativa della curcumina. La sua dimostrata capacità di inibire il VEGF e i fattori di trascrizione nucleare hanno condotto la comunità scientifica a ipotizzare un potenziale suo effetto nel coadiuvare il trattamento di diverse patologie retiniche in cui la componente infiammatoria/ossidativa gioca un ruolo importante. Recenti lavori, inoltre, hanno ulteriormente dimostrato il meccanismo d’azione della curcumina in modelli sperimentali di RD (10,11).
Purtroppo, la curcumina risulta essere scarsamente biodisponibile; la maggior parte infatti viene escreta subito dopo la sua ingestione orale e la restante parte viene metabolizzata in derivati non più attivi, per cui il problema della sua instabilità e della sua scarsa biodisponibilità è stato alla base dell’insuccesso di diversi studi clinici.
Numerose formulazioni sono state proposte per risolvere questo problema e recenti lavori dimostrano che la curcumina in formulazione con un carrier idrofilo (PVP) riesce ad avere una biodisponibilità 46 volte superiore rispetto all’estratto secco di curcumina (12). La formulazione di curcumina in carrier idrofio (Diabec, Alfa Intes) è stata anche valutata a confronto con altre formulazioni (curcumina fitosomiale e curcumina + piperina) per la sua capacità di raggiungere il sito target nelle patologie retiniche in uno studio di farmacocinetica oculare dopo singola somministrazione nel coniglio. Solo la curcumina in carrier idrofilo, rispetto alle formulazioni a confronto, risulta biodisponibile in retina già dopo singola somministrazione. Il picco massimo dopo singola somministrazione della formulazione in carrier idrofilo con un contenuto di 120 mg di curcuminoidi, si raggiunge dopo 6 ore dalla somministrazione e si dimezza dopo 12 ore (13).
Studio multicentrico
Il nostro gruppo in collaborazione con l’Università Humanitas Gavazzeni di Bergamo e l’Università della “Magna Graecia” di Catanzaro ha portato avanti uno studio multicentrico, randomizzato, controllato in singolo cieco con l’obiettivo di verificare se l’aggiunta di un nutraceutico a base di curcumina a una terapia a base di desametasone a lento rilascio per via intravitreale (IV) poteva influire sulle caratteristiche morfologiche e sui tempi di ritrattamento nei pazienti affetti da EMD (14).
Sono stati arruolati pazienti affetti da EMD clinicamente significativo in trattamento con desametasone a lento rilascio per via IV e divisi in due gruppi:
- GRUPPO A - gruppo controllo, desametasone a lento rilascio IV
- GRUPPO B - terapia combinata di desametasone a lento rilascio IV e nutraceutico per os in capsule a base di curcumina in carrier idrofilo (2 cp/die Diabec®, AlfaIntes).
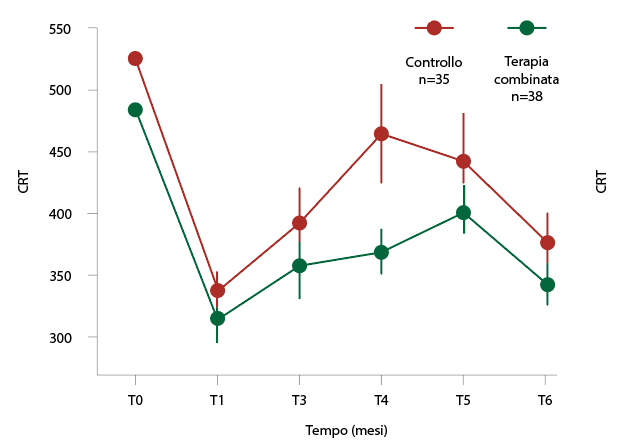
La durata dello studio è stata di 6 mesi. Tutti i pazienti sono stati sottoposti a visita oculistica completa ed esame OCT con misurazione dello spessore retinico centrale (CRT), spessore della retina interna (Inner Retinal Layer, IRL), spessore della retina esterna (Outer Retinal Layer, ORL) tutti i mesi. Tutti i pazienti sono stati trattati alla baseline con DEX-IVT e ritrattati secondo criteri predefiniti secondo un regime PRN a partire dal mese 3 se si è verificata una persistenza/recidiva di EMD, definita come presenza di liquido intra o sottoretinico su OCT, anche in assenza di calo del visus. Abbiamo arruolato 73 pazienti di cui 35 sono stati assegnati al gruppo di controllo e 38 pazienti sono stati assegnati al gruppo con terapia combinata. I risultati dello studio hanno dimostrato che mentre lo spessore retinico centrale (CRT) basale non differiva significativamente nei due gruppi (p=0.07), il cambiamento dello spessore retinico a 6 mesi era significativamente a favore del gruppo della terapia combinata. In entrambi i gruppi il CRT subiva una riduzione significativa con una riduzione maggiore (al quarto mese) nel gruppo della terapia combinata (p=0.01) (fig. 1).
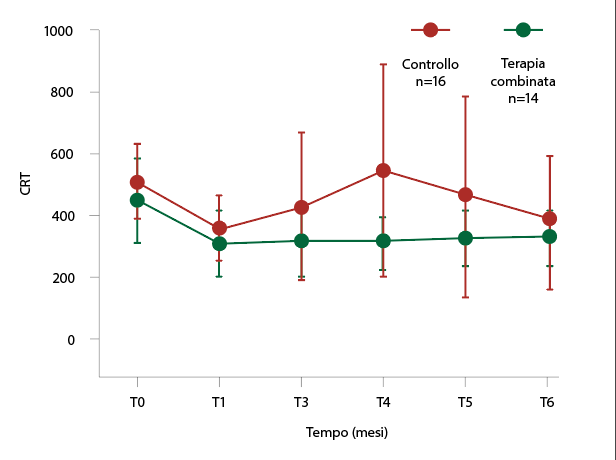
Valutando il sottogruppo dei pazienti con una diagnosi di diabete inferiore ai 10 anni, si è evidenziata una riduzione significativa (p=0.002) al mese 4 dello spessore retinico centrale nel gruppo che assumeva la terapia combinata (fig. 2).
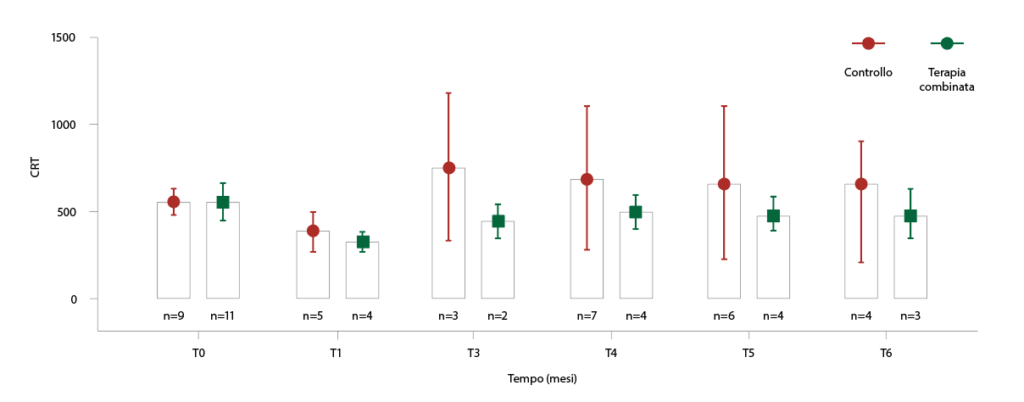
Abbiamo valutato anche la sottopopolazione dei pazienti che presentavano al basale un distacco subfoveale del neuroepitelio (DNE), biomarker infiammatorio. Nel gruppo di pazienti sottoposti a terapia combinata è stato evidenziato un trend di maggior riduzione del CRT rispetto al gruppo controllo; a ciascuna visita di follow-up, la percentuale di pazienti con SND era del 17% nel gruppo controllo e del 10% del gruppo che assumeva la terapia combinata (fig. 3).
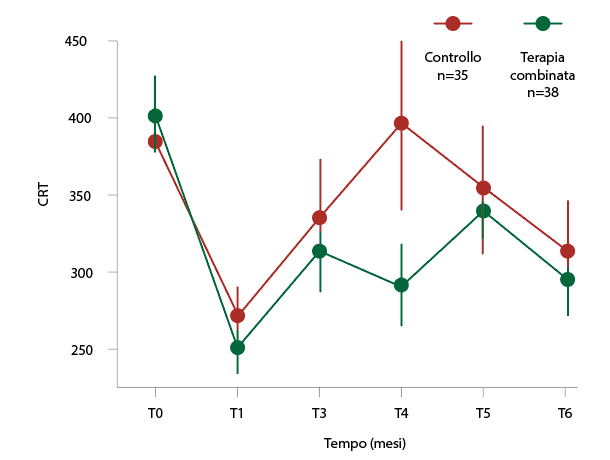
Durante lo studio abbiamo, inoltre, analizzato lo spessore dei diversi strati retinici e abbiamo riscontrato, nei pazienti sottoposti a terapia combinata, una riduzione statisticamente significativa dello strato IRL al mese 4. La riduzione dell’IRL è stata del 28% nel gruppo di terapia combinata rispetto al gruppo di controllo (fig. 4).
Conclusioni
I risultati, pertanto, hanno evidenziato che il trattamento combinato era ben tollerato dai pazienti (assenza di eventi avversi), inducendo un maggiore miglioramento anatomico (significativa riduzione del CRT e dello spessore IRL), in assenza di una differenza significativa nella acuità visiva tra i due gruppi. I benefici della terapia combinata sono stati più evidenti nei pazienti che presentavano diabete da meno di 10 anni o che presentavano distacco del neuroepitelio subfoveale. Pertanto, il supporto della nutraceutica rappresenta una opzione terapeutica coadiuvante da considerare nel trattamento dell’edema maculare diabetico soprattutto nei pazienti con pattern infiammatorio ed in stadi precoci della malattia.
- Yau et al., Diabetes Care 2012 Mar, 35(3):556-64
2. Varma et al., Prevalance of and risk factors for diabetic macular edema in the United States. JAMA Ophthalmol. 2014 Nov; 132 (11):1334-40
3. Klein et al., The Wisconsin epidemiologic study of diabetic retinopathy.IV. Diabetic macular edema. Ophtalmology 1984;91:1464-1474
4. Diabetic Retinopathy: Vascular and Inflammatory Disease. Semeraro F, J Diabetes Res. 2015:582060
5. Dexamethasone intravitreal implant in the treatment of diabetic macular edema. Dugel PU et al. Clin Ophthalmol. 2015. eCollection 2015.
6. Treatment options for diabetic macular edema. Berco E et al. Harefuah. 2017 Feb;156(2):109-113
7. Practical Lessons from Protocol T for the Management of Diabetic Macular Edema. Mukkamala L. et al. Dev. Ophthalmol 2017;60:109-124.
8. Curcumin, a potential therapeutic candidate for retinal diseases Lei-Lei Wang et al. Mol. Nutr. Food Res. 2013, 00,1–12
9. Curcumin Attenuates Retinal Vascular Leakage by inhibiting Calcium /Calmodulin- Dependent Protein Kinase II activity in Streptozotocin-induced Diabetes. Li J. et al. Cell Physiol Biochem.2016;39(3):1196-208
10. Curcumin inhibits neuronal Loss in the retina and elevates CA2+/ Calmodulin-dependent Protein Kinase II Activity in Diabetic Rats. Li J. et al. J Ocul Pharmacol Ther.2015 Nov;31(9):555-62
11. Comparative absorption of curcumin formulations Jäger R et al. Nutr J. 2014 Jan 24;13:11
12. Retinal Protection and Distribution of Curcumin in Vitro and in Vivo. Platania CBM, Fidilio A, Lazzara F, Piazza C, Geraci F, Giurdanella G, Leggio GM, Salomone S, Drago F, Bucolo C. Front Pharmacol. 2018 Jun 22;9:670.
13. Analgesic Efficacy and Safety of Curcuminoids in Clinical Practice: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Sahebkar A, et al. Pain Med. 2016 Jun;17(6):1192-202.
14. Effectiveness of a Hydrophilic Curcumin-Based Formulation in Coadjuvating the Therapeutic Effect of Intravitreal Dexamethasone in Subjects With Diabetic Macular Edema. Parravano M, Allegrini D, Carnevali A, Costanzo E, Giannaccare G, Giorno P, Scorcia V, Spedicato GA, Varano M, Romano MR.Front Pharmacol. 2022 Jan 4;12:726104. doi: 10.3389/fphar.2021.726104. eCollection 2021.