Riassunto
La degenerazione maculare legata all’età (DMLE) è una patologia retinica progressiva e una delle principali cause di perdita della visione centrale negli individui sopra i cinquant’anni nei paesi industrializzati. La DMLE è classificata in due forme: secca (o non-essudativa) e umida (o essudativa). La DMLE non-essudativa, più frequente tra le due, è causata da un difetto dell’epitelio pigmentato retinico, portando alla formazione di aggregati lipoproteici chiamati drusen. La DMLE non-essudativa, progredendo, evolve in atrofia geografica, che ne rappresenta la sua fase più avanzata. Il sistema del complemento, tra cui i fattori C3, C5, H e I, gioca un ruolo importante nella patogenesi, rappresentando un potenziale target terapeutico. Al momento sono in corso diversi trial terapeutici, tra cui la terapia cellulare, l’assunzione di farmaci neuroprotettivi, antinfiammatori o immunomodulatori e la fotobiomodulazione. Quest’ultima consiste nell’irraggiamento luminoso della retina con specifiche lunghezze d’onda per stimolarne il metabolismo cellulare. Sebbene la letteratura in merito sia insufficiente al momento, gli studi clinici finora condotti ne hanno confermato efficacia e sicurezza.
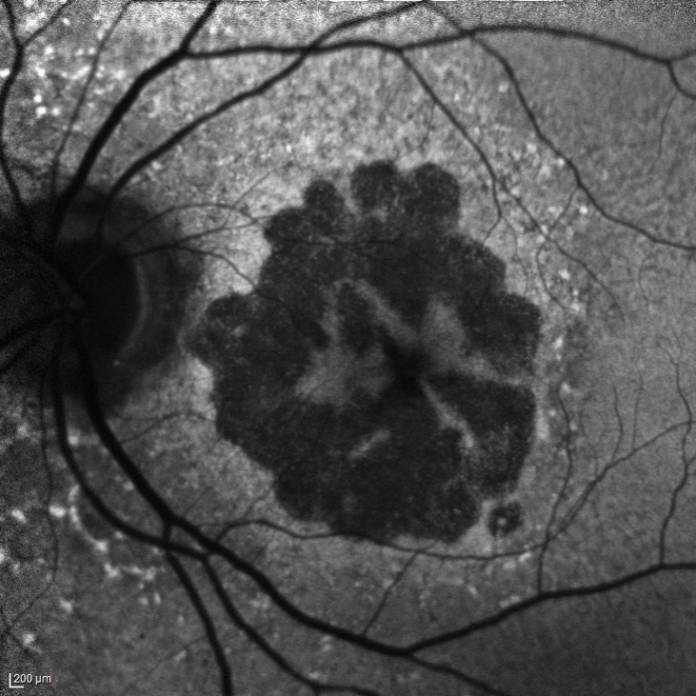
La degenerazione maculare legata all’età (DMLE) è una malattia retinica progressiva ed è la principale causa di perdita della visione centrale nella popolazione sopra i 50 anni nei paesi sviluppati. La DMLE è classificata in due tipi: secca (o non-essudativa), e umida (o essudativa). La DMLE non-essudativa, più frequente tra le due, è causata da difetti dell’epitelio pigmentato retinico, che portano, nella regione maculare, alla formazione di aggregati proteici e lipidici chiamati drusen. Come determinato nello studio AREDS, le piccole drusen (druplets) sono considerate un fenomeno parafisiologico legato all’invecchiamento, mentre quelle intermedie e grandi correlano direttamente con lo sviluppo della DMLE. Nelle forme più gravi, la degenerazione maculare non-essudativa evolve fino all’atrofia geografica (GA, dall’inglese geographic atrophy), che ne rappresenta la fase più avanzata. Essa è conseguente alla progressiva perdita di fotorecettori, cellule dell'epitelio pigmentato retinico e membrana di Bruch. Questa forma di degenerazione retinica colpisce circa 5 milioni di individui in tutto il mondo, con numeri in continuo aumento. Sono infatti previsti circa 19 milioni di casi globali nel 2040 (1,2).
Progressione e fattori di rischio dell’atrofia geografica
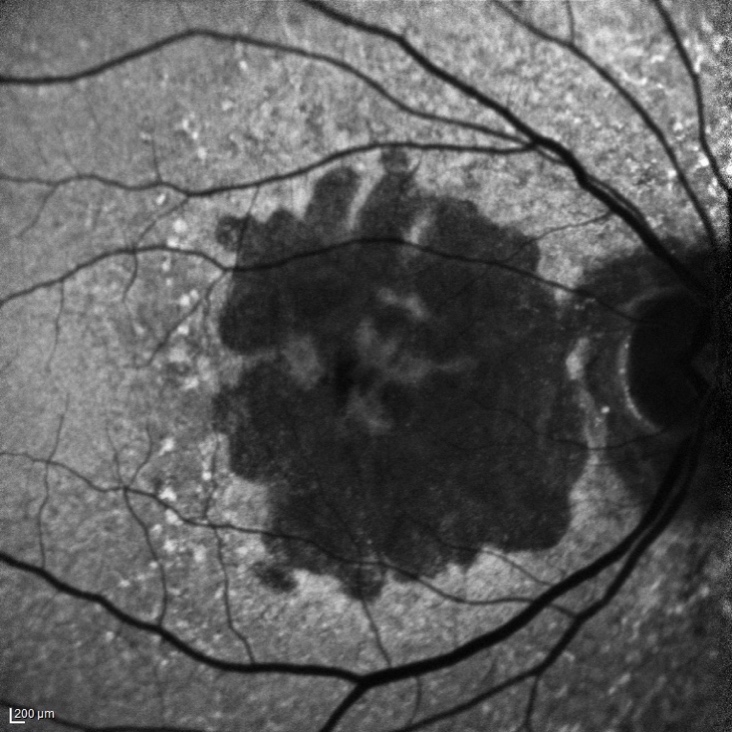
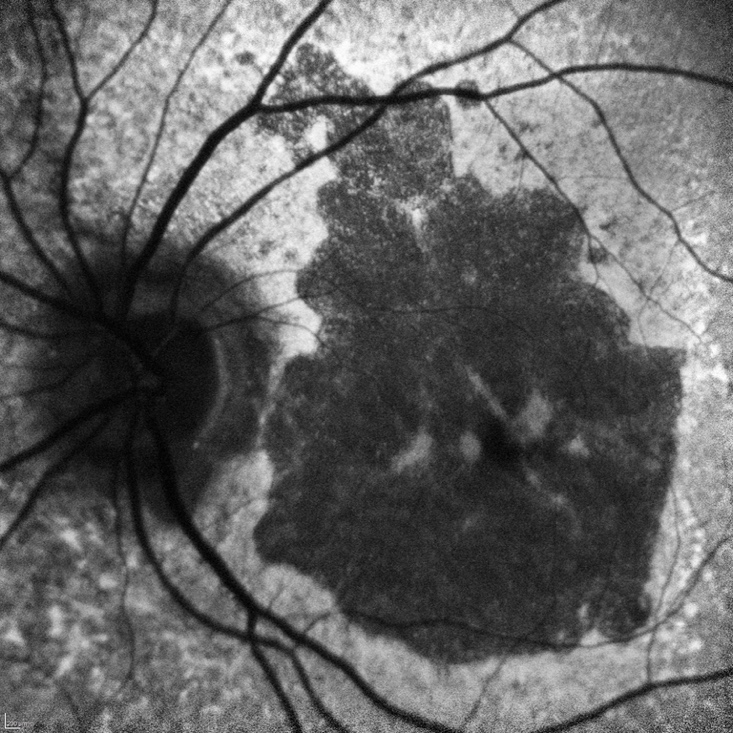
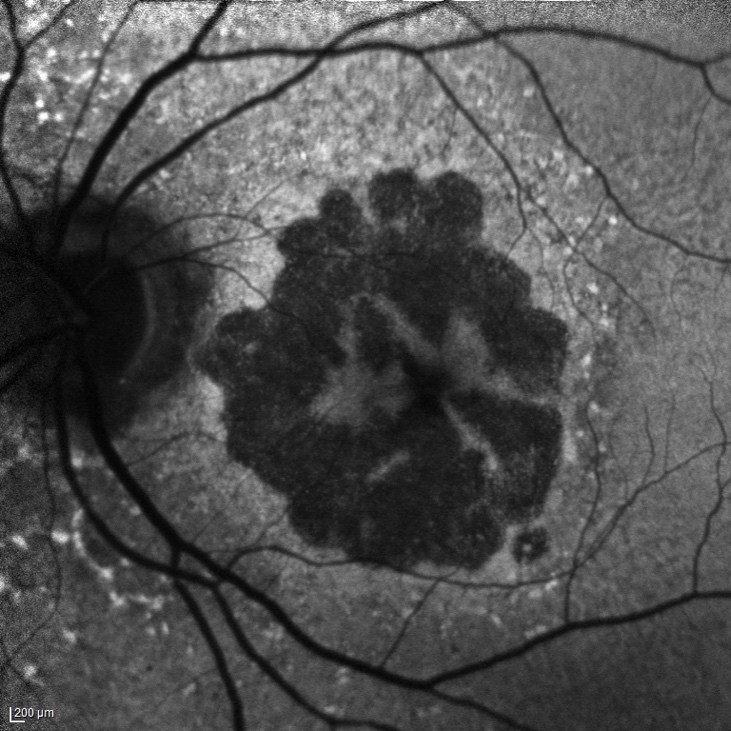
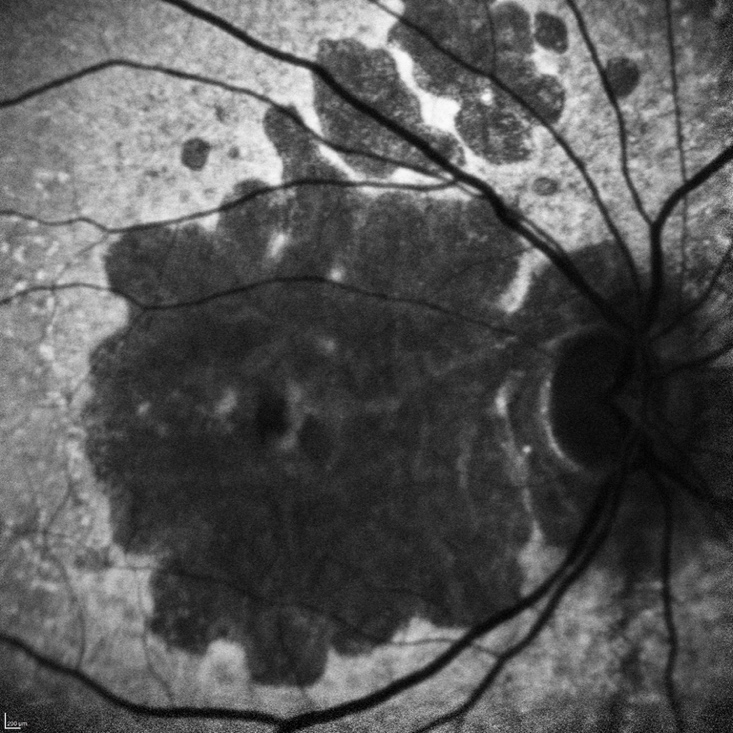
L'ingrandimento delle lesioni e quindi la progressione della malattia portano a una diminuzione della funzione visiva, specialmente quando l’atrofia raggiunge la fovea. Tra i più classici fattori intrinseci alla malattia che segnalano un aumentato rischio di progressione si annoverano la presenza di GA nell’occhio adelfo e la presenza di lesioni extrafoveali. Queste caratteristiche possono essere facilmente rilevate con un comune esame del fondo dell’occhio o una retinografia a colori, e approfondite per mezzo della tomografia a coerenza ottica (OCT) (figura 1).
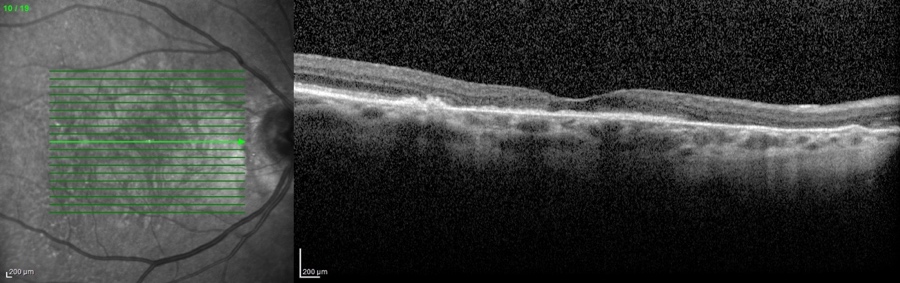
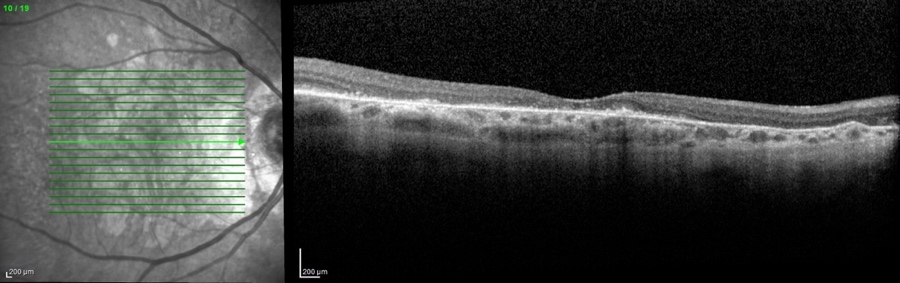
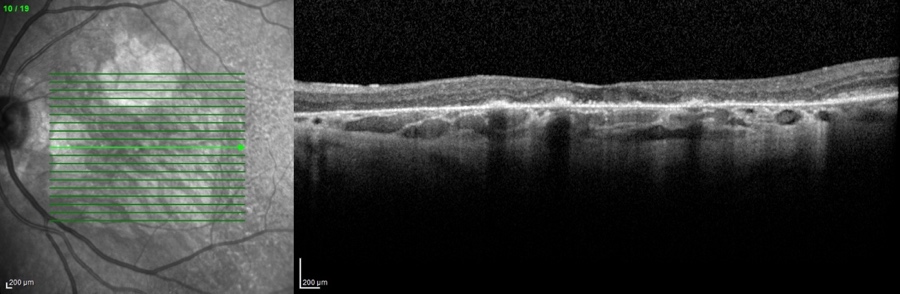
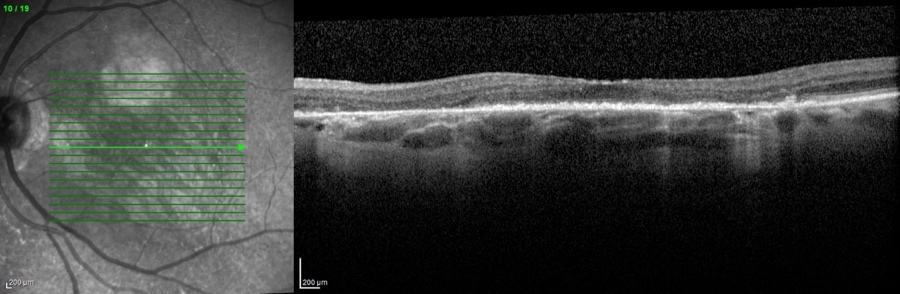
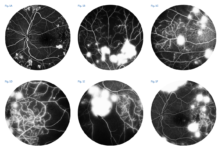
Più recentemente, l’introduzione dell’autofluorescenza del fondo a luce blu (blue-light fundus autofluorescence, BAF), metodica di riferimento nei trial clinici, ha permesso di dimostrare che anche la dimensione e il pattern della lesione influenzano il tasso di crescita dell’atrofia (figura 2). In particolare, lo studio FAM (acronimo di fundus autofluorescence in age-related macular degeneration) ha dimostrato come la velocità di progressione nei casi senza alcuna alterazione in BAF sia la più bassa in assoluto (0,38 mm2/anno), mentre nei casi caratterizzati da un’aumentata autofluorescenza al di fuori della lesione essa sia molto più alta (1,77 mm2/anno). All’interno di quest’ultima categoria si distingue un ulteriore pattern con il più alto tasso di progressione in assoluto (3.02 mm2/anno), denominato diffuse trickling geographic atrophy (DTGA) (3,4). Diversi fattori estrinseci alla malattia influenzano il rischio di GA, tra cui l'età, la genetica e il fumo. I fattori genetici sono un fattore chiave nella progressione della DMLE e della GA, con diverse varianti genetiche comuni legate alla DMLE e alla formazione della GA. In questo contesto, i fattori C3, C5, H, ed I del sistema del complemento, che comprende una cascata di funzioni enzimatiche all'interno della risposta immunitaria, giocano un ruolo preminente e pertanto sono stati individuati come target per potenziali terapie future (5).
Trattamenti: prospettive future Diverse opzioni farmacologiche sono state studiate per il trattamento della DMLE secca e dell’atrofia geografica negli ultimi anni. Uno dei trattamenti più comuni per l'atrofia geografica è l'assunzione di integratori alimentari contenenti vitamine e antiossidanti, come la luteina, la zeaxantina, la vitamina C ed E, l'acido folico e lo zinco.
Questi integratori si sono dimostrati utili nel rallentare la progressione della malattia in alcuni pazienti, soprattutto in coloro che presentano bassi livelli di antiossidanti nel sangue (6). Anche gli agenti neuroprotettivi, che proteggono le cellule retiniche dal danno e migliorano la funzione cellulare, sono una promettente opzione farmacologica (7). Uno di questi è il fattore neurotrofico ciliare (CNTF), una proteina che promuove la sopravvivenza e la crescita delle cellule retiniche.
Un trial clinico ha dimostrato che pazienti con DMLE secca sottoposti a iniezioni intravitreale di impianto a rilascio sostenuto di CNTF hanno avuto miglioramenti significativi della funzione visiva rispetto a quelli che hanno ricevuto un placebo. Integratori alimentari quali lo zafferano e gli omega-3, così come trattamenti topici come il tartrato di brimonidina (un farmaco normalmente utilizzato per trattare il glaucoma) hanno mostrato alcuni risultati promettenti in studi preliminari. Tuttavia, ulteriori ricerche sono necessarie per determinare la loro efficacia e sicurezza.
Anche alcuni farmaci antinfiammatori e immunomodulatori possono avere un ruolo nel trattamento della DMLE secca (8).
Lampalizumab è un anticorpo monoclonale il cui bersaglio è il fattore D del complemento, che, inibito, non è più in grado di entrare a far parte del complesso di attacco alla membrana plasmatica. Un trial clinico ha riscontrato che i pazienti con atrofia geografica sottoposti a iniezioni intravitreali di lampalizumab hanno avuto una significativa riduzione del tasso di progressione di malattia rispetto a coloro che hanno ricevuto un placebo.
Un’altra molecola oggetto di studio è Zimura, che inibisce il sistema del complemento prevenendo l'attivazione del C5, altra proteina coinvolta nella formazione del complesso di attacco alla membrana. Uno studio clinico ha dimostrato che i pazienti con atrofia geografica che hanno ricevuto iniezioni intravitreali di Zimura hanno registrato una significativa riduzione del tasso di progressione della malattia rispetto a quelli che hanno ricevuto un placebo.
Uno dei trattamenti più comuni per l'atrofia geografica è l'assunzione di integratori alimentari contenenti vitamine e antiossidanti, come la luteina, la zeaxantina, la vitamina C ed E, l'acido folico e lo zinco. Questi integratori si sono dimostrati utili nel rallentare la progressione della malattia in alcuni pazienti, soprattutto in coloro che presentano bassi livelli di antiossidanti nel sangue.
La terapia a base di cellule staminali viene anche studiata come potenziale opzione di trattamento per la DMLE secca. Esse hanno il potenziale di rigenerare le cellule retiniche danneggiate e migliorare la funzione visiva. Uno studio clinico ha evidenziato che i pazienti con DMLE secca che hanno ricevuto iniezioni intravitreali di cellule staminali epiteliali di pigmento retinico hanno avuto significativi miglioramenti dell'acuità visiva e della sensibilità retinica.
Fra i trattamenti non farmacologici, si è parlato ultimamente di fotobiomodulazione, altrimenti nota come fototerapia laser a bassa intensità. Si tratta di una terapia recentemente utilizzata non solo in oftalmologia, ma anche in cardiologia, neurologia e oncologia (9). Questa tecnologia sfrutta la radiazione luminosa monocromatica di lunghezza d’onda compresa tra i 600 e 1000 nm per stimolare la funzione delle cellule irradiate, senza danneggiare o scaldare i tessuti trattati.
In particolare, il bersaglio del trattamento è una proteina chiamata citocromo ossidasi C. Si tratta di un enzima contenuto all’interno del mitocondrio, coinvolto nel ciclo respiratorio cellulare nelle sue fasi finali. La radiazione laser trasmessa viene assorbita dalle molecole di rame contenute all’interno della proteina, aumentandone la funzione (10). A partire da questo enzima il segnale viene trasdotto seguendo diverse vie, tra cui quella di maggior interesse coinvolge la produzione di adenosin-trifosfato (ATP).
Questa molecola è riconosciuta essere la principale fonte di energia per qualsiasi cellula del nostro organismo ed è noto che sue fluttuazioni quantitative possono incidere sul corretto funzionamento delle stesse. È dimostrato che la fotobiomodulazione induce un aumento nella sintesi di ATP, permettendo alla cellula di svolgere al meglio le proprie funzioni (11). Questo effetto è ancor più evidente se le cellule sono ipofunzionanti o malate. Recenti studi inoltre hanno evidenziato che questa molecola non ha solo funzione energetica.
Infatti, legandosi a specifici recettori sulla membrana plasmatica, attiva il rilascio delle riserve di calcio intracellulare. In questo senso quindi, tramite la produzione di una maggior quantità di ATP, la fototerapia laser a bassa intensità stimola il rilascio di questo ione, con effetti notoriamente positivi sul metabolismo mitocondriale (9).
Integratori alimentari quali lo zafferano e gli omega-3, così come trattamenti topici come il tartrato di brimonidina (un farmaco normalmente utilizzato per trattare il glaucoma) hanno mostrato alcuni risultati promettenti in studi preliminari.
La fotobiomodulazione agisce anche attraverso altre vie. Ad esempio, è in grado di regolare la produzione di monossido di azoto e di specie reattive dell’ossigeno, responsabili a loro volta della trasduzione del segnale di Nf-kB. Questo enzima è coinvolto sia nella cascata infiammatoria che nell’attivazione dell’apoptosi, processi estremamente importanti in corso di degenerazione maculare legata all’età.
Inoltre, la fototerapia laser a bassa intensità è in grado di prevenire questi processi attraverso la stimolazione di geni antiapoptotici quali heat-shock protein ed enzimi antiossidanti (12).
Sebbene promettente, la letteratura a favore di questa tecnica rimane esigua e insufficiente per potersi sbilanciare sul suo futuro. Comunque, i trial clinici condotti fino ad oggi ne hanno dimostrato sicurezza ed efficacia (12). Il protocollo terapeutico adottato prevede l’applicazione del trattamento in 3 sessioni a distanza di 4 mesi uno dall’altro. Ognuna di esse è composta da 9 applicazioni, da completare in 3-5 settimane circa. Durante la procedura, della durata di circa 5 minuti, la retina viene irradiata con radiazione luminosa monocromatica di lunghezza d’onda pari a 590nm, 660nm, 850nm.
Seguendo questo protocollo terapeutico, i pazienti trattati hanno avuto un aumento del numero di caratteri letti e un miglior controllo del quadro anatomico. Infatti, i risultati mostrano che, sebbene in maniera non statisticamente significativa, il volume delle drusen e la progressione dell’atrofia siano ridotti rispetto ai pazienti non sottoposti al trattamento (12).
In conclusione, la degenerazione maculare senile secca è una patologia sempre più frequente nella popolazione generale che purtroppo attualmente non conosce terapie altamente efficaci. Nonostante ciò, negli ultimi anni la ricerca ha permesso lo sviluppo di farmaci e trattamenti che, sebbene nelle prime fasi di studio, ci permettono di ottenere risultati terapeutici mai raggiunti fino ad oggi.
Gli autori dichiarano l’assenza di conflitti di interesse.
- Schmitz-Valckenberg S, Sahel JA, Danis R, et al. Natural History of Geographic Atrophy Progression Secondary to Age-Related Macular Degeneration (Geographic Atrophy Progression Study). Ophthalmology. 2016;123(2):361-368. doi:10.1016/j.ophtha.2015.09.036
- Fleckenstein M, Mitchell P, Freund KB, et al. The Progression of Geographic Atrophy Secondary to Age-Related Macular Degeneration. Ophthalmology. 2018;125(3):369-390. doi:10.1016/j.ophtha.2017.08.038
- Holz FG, Bindewald-Wittich A, Fleckenstein M, Dreyhaupt J, Scholl HPN, Schmitz-Valckenberg S. Progression of Geographic Atrophy and Impact of Fundus Autofluorescence Patterns in Age-related Macular Degeneration. American Journal of Ophthalmology. 2007;143(3):463-472.e2. doi:10.1016/j.ajo.2006.11.041
- Fleckenstein M, Schmitz-Valckenberg S, Lindner M, et al. The “Diffuse-Trickling” Fundus Autofluorescence Phenotype in Geographic Atrophy. Invest Ophthalmol Vis Sci. 2014;55(5):2911. doi:10.1167/iovs.13-13409
- Desai D, Dugel PU. Complement cascade inhibition in geographic atrophy: a review. Eye. 2022;36(2):294-302. doi:10.1038/s41433-021-01765-x
- Agrón E, Mares J, Clemons TE, Swaroop A, Chew EY, Keenan TDL. Dietary Nutrient Intake and Progression to Late Age-Related Macular Degeneration in the Age-Related Eye Disease Studies 1 and 2. Ophthalmology. 2021;128(3):425-442. doi:10.1016/j.ophtha.2020.08.018
- Lin JB, Murakami Y, Miller JW, Vavvas DG. Neuroprotection for Age-Related Macular Degeneration. Ophthalmology Science. 2022;2(4):100192. doi:10.1016/j.xops.2022.100192
- Spaide RF, Vavvas DG. Complement Inhibition for Geographic Atrophy: Review of Salient Functional Outcomes and Perspective. Retina. 2023;Publish Ahead of Print. doi:10.1097/IAE.0000000000003796
- Karu T. Mitochondrial Mechanisms of Photobiomodulation in Context of New Data About Multiple Roles of ATP. Photomedicine and Laser Surgery. 2010;28(2):159-160. doi:10.1089/pho.2010.2789
- Karu T. Primary and secondary mechanisms of action of visible to near-IR radiation on cells. Journal of Photochemistry and Photobiology B: Biology. 1999;49(1):1-17. doi:10.1016/S1011-1344(98)00219-X
- Passarella S, Karu T. Absorption of monochromatic and narrow band radiation in the visible and near IR by both mitochondrial and non-mitochondrial photoacceptors results in photobiomodulation. Journal of Photochemistry and Photobiology B: Biology. 2014;140:344-358. doi:10.1016/j.jphotobiol.2014.07.021
- Burton B, Parodi MB, Jürgens I, et al. LIGHTSITE II Randomized Multicenter Trial: Evaluation of Multiwavelength Photobiomodulation in Non-exudative Age-Related Macular Degeneration. Ophthalmol Ther. 2023;12(2):953-968. doi:10.1007/s40123-022-00640-6