Il glaucoma è una neuropatia ottica caratterizzata da peculiari alterazioni della morfologia della testa del nervo ottico, dello strato delle fibre nervose retiniche (RNFL), e del campo visivo (VF).
La perimetria computerizzata standard acromatica è tuttora la metodica di elezione per la valutazione del campo visivo che, a sua volta, è un test di fondamentale importanza per la diagnosi e il follow-up di pazienti affetti da glaucoma.
La tempestiva individuazione di peggioramenti perimetrici permette di mettere in atto misure terapeutiche per preservare la funzione visiva e prevenire la disabilità (1).
Di pari importanza è anche la determinazione della velocità di progressione per diverse ragioni.
In primo luogo, tutti i soggetti vanno in contro nel corso della loro vita a un declino perimetrico parafisiologico come conseguenza dell’invecchiamento, e per contestuali patologie non legate alla malattia glaucomatosa come la cataratta.
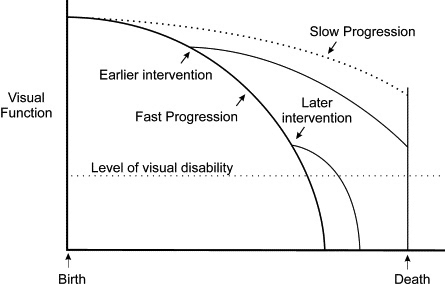
In seconda istanza, la determinazione della velocità di progressione permette di distinguere tra pazienti a progressione lenta e a progressione veloce, per potere trattare questi ultimi con una strategia terapeutica più aggressiva e follow-up più intenso (figura 1).
A conferma della sua particolare rilevanza, numerosi studi hanno individuato come outcome primario proprio la progressione perimetrica (2-5).
La determinazione della progressione perimetrica e della sua velocità sono però rese di difficile interpretazione dalla variabilità presente tra esami successivi, denominata “fluttuazione a lungo termine”.
La fluttuazione è di maggior entità in pazienti affetti da glaucoma rispetto a soggetti sani (6), e sembra essere dovuta alla presenza di cellule ganglionari sofferenti che a volte rispondono meglio e a volte peggio alla stimolazione luminosa, e alla naturale aumentata difficoltà nell’esecuzione dell’esame man mano che la malattia va avanti.
Tipica è infatti la fluttuazione della sensibilità nelle aree peri-scotomatose.
Età, eccentricità della fissazione, sensibilità iniziale, presenza di altre patologie oculari, e strategia dell’esame perimetrico rappresentano ulteriori fattori modulanti la fluttuazione a lungo termine (7).
Per essere ritenuto reale, un cambiamento del campo visivo deve sovrastare la quantità di rumore di fondo presente nella sequenza perimetrica ed essere replicabile in esami successivi (8).
Diversi approcci sono stati sviluppati al fine di identificare e misurare la progressione perimetrica.
Tuttavia, nessuna di queste metodiche può essere considerata come gold standard, e l’individuazione tempestiva della progressione perimetrica rimane tuttora uno dei compiti più ardui per l’oftalmologo.
Tali metodi sono raggruppabili in “valutazione soggettiva”, “metodiche basate sull’evento” e “metodiche basate sul trend”.
Glaucoma: valutazione soggettiva
La valutazione soggettiva da parte dell’oftalmologo di sequenze perimetriche è uno dei metodi più comunemente utilizzati, specialmente nella normale attività clinica.
Essa consiste nell’accurata analisi di tutti i campi visivi eseguiti dal paziente senza l’ausilio dei programmi statistici disponibili sui vari perimetri.
Tale metodica presenta numerosi vantaggi, come la sua rapidità, il basso costo, e l’indipendenza da qualsiasi supporto informatico (9).
Tuttavia, la sua intrinseca soggettività e la mancanza di standardizzazione rappresentano limiti rilevanti.
Numerosi studi hanno infatti mostrato livelli di discordanza di interpretazione tra clinici esperti, nonostante un’eccellente riproducibilità intra-operatore (10, 32).
Inoltre, se da un lato la valutazione soggettiva è in grado di individuare cambiamenti rapidi del campo visivo, dall’altro manca la componente lenta del declino perimetrico (10).
Altri limiti della valutazione soggettiva nella pratica clinica quotidiana sono il fatto che il paziente non sempre si reca dal medico con tutti gli esami eseguiti, e il fatto che gli esami sono eseguiti su macchinari differenti, con programma e/o con strategia di studio differenti.
Metodiche basate sull’evento
Le metodiche basate sull’evento si fondano sull’identificazione di un cambiamento perimetrico statisticamente significativo nel tempo, denominato appunto “evento”, rispetto a uno o più test di riferimento.
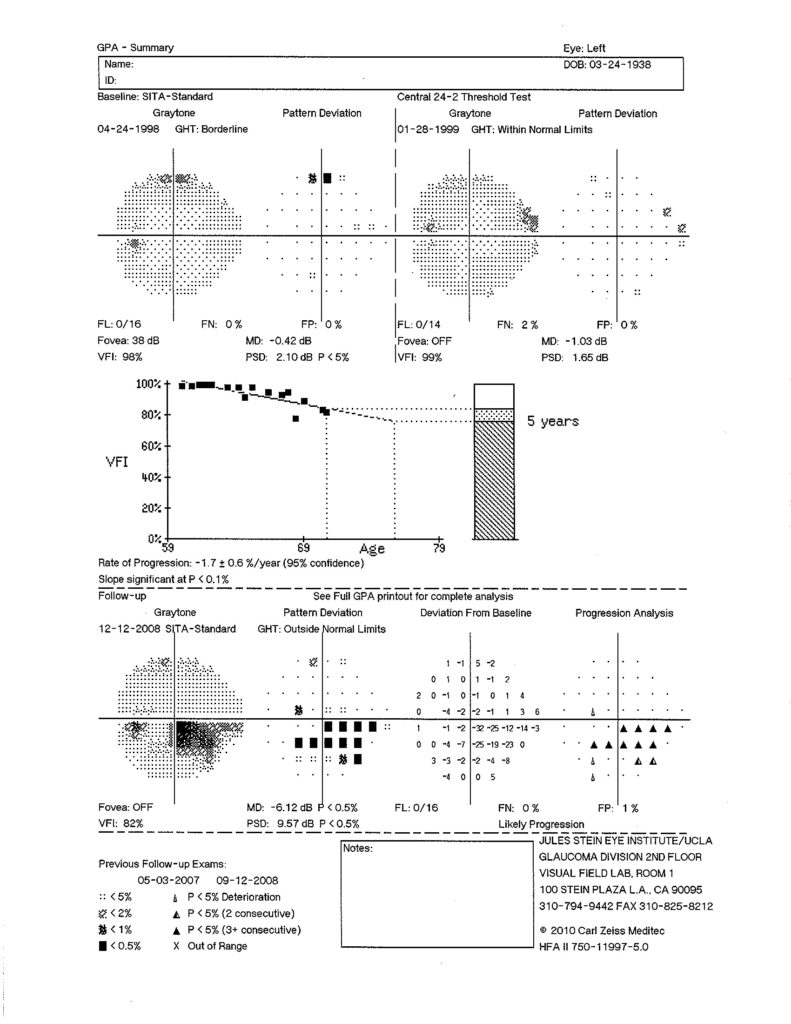
Tra tali metodiche, si annovera il “Guided progression analysis” (GPA), algoritmo dell’Humphrey field analyzer (HFA) (Carl Zeiss Meditec, Inc., Dublin, CA), che è stato usato dallo studio “Early manifestant glaucoma treatment” (EMGT) per stabilire la progressione perimetrica.
In accordo con i criteri usati dallo studio EMGT, tale metodo è in grado di identificare la progressione con un minimo di tre esami, in aggiunta a due esami di baseline, escludendo quelli in cui ci può essere un effetto di apprendimento.
In caso di peggioramento statisticamente significativo il programma pone un triangolino bianco, che diventerà bianco e nero se il peggioramento è confermato nell’esame successivo e che diventerà nero se il peggioramento è ulteriormente confermato nel terzo esame confrontato.
Inoltre un “GPA alert” suggerirà una progressione probabile o possibile quando avremo rispettivamente più di tre triangolini neri o bianchi e neri, rispettivamente (figura 2).
I sistemi di valutazione “Advanced glaucoma treatment study” (AGIS) e “Collaborative initial glaucoma treatment study” (CIGTS), adottati negli omonimi studi clinici, sono altre due metodiche basate sull’evento (2, 5).
Entrambi i metodi valutano ogni esame perimetrico con un punteggio da 0 a 20 basato rispettivamente sulla “total deviation numerical plot” e sulla “total deviation probability map”.
Un incremento del punteggio di ³4 (AGIS) o ³3 (CIGTS) unità rispetto al baseline e sostenuto in almeno 3 visite consecutive è giudicato progressione perimetrica.
Heijl e colleghi (11) hanno confrontato le proprietà dei sistemi EMGT, AGIS e CIGTS usando l’opinione di esperti come metodo di riferimento.
In tale studio, la metodica GPA si è rivelata la più sensibile e la più rapida, ma anche la meno specifica.
I sistemi AGIS and CIGTS avevano simili proprietà diagnostiche tra loro.
Tali risultati sono stati riconfermati da uno studio successivo in cui sequenze perimetriche longitudinalmente simulate al computer erano usate come metodica di riferimento (12).
Sebbene pazienti con significative fluttuazione perimetriche ed esami non attendibili possano essere erroneamente marcati come in progressione perimetrica (13, 14), studi precedenti hanno riportato che la GPA ha una specificità soddisfacente.
L’elevata specificità dei sistemi AGIS e CIGTS è invece da ascriversi al fatto che tali metodiche sono fortemente conservative, e una sostanziale variazione sostenuta nel tempo è necessaria per definire una sequenza perimetrica come in progressione.
Di contro, tali metodiche sono limitate dal lungo tempo e dall’elevato numero di esami richiesti per identificare la progressione, e per la mancata identificazione di pazienti realmente in progressione.
Mayama et al (15) hanno riportato che un incremento del punteggio AGIS di ≥ 4 unità in 2 (e non in 3) visite consecutive è in grado di aumentare la sensibilità del test del 50% con modificazioni trascurabili nella specificità.
Tuttavia, le metodiche basate sull’evento sono gravate da importanti limitazioni.
Il principale limite è rappresentato dal fatto che esse considerano la progressione come un evento binario, dividendo dicotomicamente le sequenze perimetriche come “in progressione” e “non in progressione”.
Tale assunto, oltre ad essere teoricamente scorretto (in quanto non tiene in considerazioni del normale declino perimetrico correlato all’età), non permette la determinazione della velocità di progressione, e di conseguenza, di discriminare i pazienti in base alla loro velocità di progressione.
Altri limiti derivano dalla forte dipendenza dagli esami di baseline e dalla mancata considerazione dell’intera sequenza perimetrica.
Metodiche basate sul trend
I modelli di regressione basati sul trend sono strumenti largamente utilizzati per la valutazione dell’andamento di sequenze perimetriche.
La maggior parte dei metodi proposti si basa su regressione lineare di indici globali, di cluster, e di singoli punti. Nella regressione lineare troviamo la pendenza della retta (coefficiente di regressione) e il valore di significatività (p value).
Se la pendenza della retta è statisticamente significativa e supera un valore soglia, ciò è indice di un peggioramento.
Tra gli indici globali, sono comunement
e utilizzati la “mean deviation” (MD) e il “visual field index” (VFI) e i loro rates lineari (16).
Tuttavia, la MD è un indice poco sensibile alla perdita glaucomatosa progressiva del campo visivo in quanto è una misura globale dello stesso e, dunque, può non individuare cambiamenti focali sebbene clinicamente significativi.
Inoltre, la MD è influenzabile dallo stato dei mezzi diottrici, come cataratta in evoluzione o chirurgia della cataratta, che sono eventi comuni nella popolazione glaucomatosa (17, 18).
Il VFI è un indice in cui ad ogni punto viene dato un peso differente a seconda della posizione nel campo visivo, per cui i punti centrali valgono di più di quelli periferici.
A parità di MD quindi un paziente con un difetto centrale avrà un VFI più basso.
È meno sensibile all’opacità del cristallino rispetto alla MD ma diventa meno affidabile negli stadi avanzati di malattia (19).
Il programma è inoltre in grado di predire quale sarà il valore del VFI a cinque anni se la progressione continuasse con quell’andamento.
Gardiner e Demirel (20) hanno comparato le performances di tre indici globali (MD, VFI e pattern standard deviation [PSD]), e hanno osservato che il rate di cambiamento della MD individua la progressione perimetrica più precocemente e frequentemente degli altri due.
Le metodiche di regressione puntiforme trattano ogni singolo punto testato individualmente.
Tali metodiche hanno il vantaggio di essere sensibili anche a cambiamenti localizzati del campo visivo, e mantengono la risoluzione spaziale.
Tra queste, una delle più utilizzate è la regressione lineare del software Progressor (Medisoft Inc., Leeds, UK).
Il sistema utilizza una leggenda grafica molto intuitiva in cui, per ogni punto, delle piccole barre esprimono la significatività dell’andamento con il colore (colori caldi molto significativo, colori freddi poco significativo) e il cambiamento della sensibilità con l’altezza (banda alta sensibilità più bassa cioè maggiore cambiamento).
Numerosi studi hanno dimostrato come metodiche puntiformi posseggano una maggiore sensibilità, ma una minore specificità rispetto a regressione di indice globali (7).
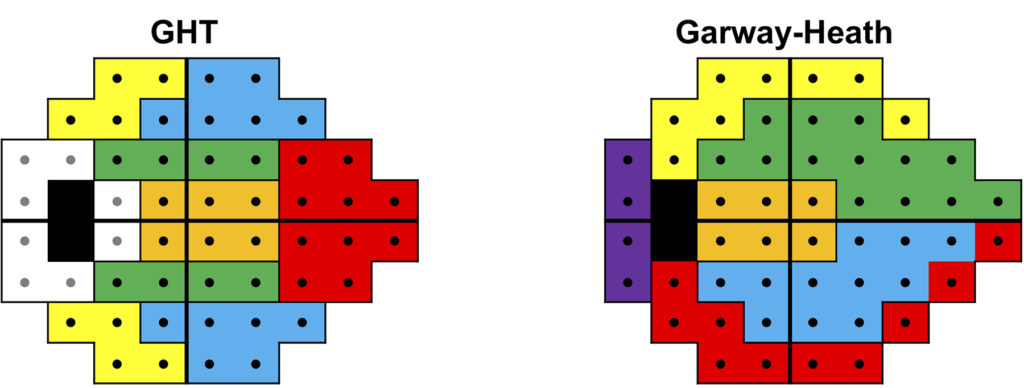
Nel tentativo di mitigare i limiti di tali metodiche, sono state proposte analisi a cluster, tra cui le più celebri sono rappresentate dal “Glaucoma hemifield test” e dalle “mappe di Garway-Heath” (figura 4).
La prima divide i due emicampi superiore e inferiore in cinque diverse zone corrispondenti e mette in relazione il valore di sensibilità dei punti nelle zone speculari.
Le mappe di Garway-Heath mettono in relazione i punti/settori testati del campo visivo con i settori della testa del nervo ottico dando una buona correlazione struttura/funzione tra i difetti RNFL e i difetti perimetrici (figura 3).
Uno studio di Gardiner e colleghi ha dimostrato come le metodiche a clusters abbiano migliori performances sia delle metodiche basate su indici globali sia puntiformi, sebbene con una specificità subottimale (21).
Nuovi algoritmi e direzioni future
La metodica “permutation of pointwise linear regression” (PoPLR) è stata recentemente proposta ed ha mostrato migliori capacità rispetto alla semplice regressione puntiforme lineare (22).
PoPLR è generata dal confronto di una sequenza di campi visivi con serie di campi visivi generati dalla permutazione casuale della sequenza originale (22).
Tale algoritmo è basato sull’assunto che una sequenza di un paziente non in progressione non differisce significativamente dalla distribuzione nulla generata dall’insieme dei campi visivi permutati.
Tuttavia, è bene ricordare che anche un occhio non affetto da glaucoma subisce nel corso del tempo un declino progressivo legato all’età o allo sviluppo di cataratta, e tali eventi possono inficiare con tale algoritmo.
Al fine di limitare tale fenomeno, PoPLR è calcolato sulla deviazione totale, che indica la differenza tra i valori di sensibilità differenziale del paziente e quello di una popolazione sana della stessa età del soggetto esaminato.
E’ bene tenere a mente che il database normativo corretto per età non tiene conto delle variazioni inter-individuali, che sono maggiormente pronunciate nelle sedi medioperiferiche e periferiche (23).
Studi pregressi hanno documentato che il corso del declino perimetrico non segue un modello lineare.
Chen et al (24) hanno comparato l’utilizzo dei modelli lineare, esponenziale, e logistico in serie perimetriche, ed hanno osservato che il modello logistico si conforma meglio all’andamento della malattia glaucomatosa, mentre il modello esponenziale ha la miglior capacità predittiva.
L’approccio esponenziale si è rivelato superiore ai modelli lineari e altri non-lineari in pazienti con malattia moderata e severa poiché è in grado di modellarsi a valori di sensibilità di 0 dB in modo asintotico, a differenza delle altre tecniche lineari (24-26).
Sulla base di tali osservazioni, è stato proposto un nuovo indice basato sulla regressione puntiforme esponenziale (e non lineare), chiamato Glaucoma rate index (GRI) (27).
La quasi totalità dei metodi enunciati non tiene in conto di due importanti proprietà del campo visivo: la correlazione spaziale tra singoli punti e la variabilità non stazionaria, ovvero l’aumento della variabilità al diminuire della sensibilità differenziale.
A tal proposito, Zhu e colleghi (28) hanno proposto una nuova metodica basata sul trend, denominata Analysis with non-stationary
weibull error regression and spatial enhancement (ANSWERS).
Tale approccio si è dimostrato più sensibile ed abile a predire cambiamenti futuri della regressione della MD e di PoPLR (28).
Diversi autori hanno cercato di integrare informazioni funzionali derivate dalla perimetria computerizzata con informazioni strutturali derivate, ad esempio, da esami con tomografia ottica a luce coerente (OCT).
Una delle principali difficoltà nel combinare queste due misure deriva dal fatto che sono espresse in unità di misura differenti.
A tal proposito, Medeiros e colleghi (29) hanno proposto un indice integrante informazioni strutturali e funzionali, previa conversione in numero di cellule ganglionari retiniche.
Avanzamenti nell’integrazione struttura/funzione per determinare la progressione perimetrica sono da attendersi con l’introduzione nel mercato dei “fundus perimetri”, come il Compass (CMP; CenterVue, Padova, Italia).
Tale strumento permette di eseguire una misura del campo visivo compensando i movimenti oculari grazie a un sistema di eye-tracking e di dislocazione dello stimolo.
Essendo equipaggiato di una fundus camera, Compass permette di integrare dati strutturali e funzionali, e permette la perfetta sovrapposizione con esami OCT eseguiti su un altro strumento.
L’intelligenza artificiale e il deep learning rappresentano importanti novità in ambito oftalmologico, con interessanti applicazioni.
Alcuni autori hanno cominciato ad applicare tale tecnologia per l’individuazione e la misura della progressione perimetrica con risultati promettenti (30).
Confronto tra metodi
Numerosi studi hanno dimostrato modesta concordanza nella valutazione della progressione tra diversi metodi (11, 12, 31, 32).
E’ stato proposto però che i diversi metodi possano cogliere aspetti diversi della progressione perimetrica, generando informazioni complementari (32, 33).
A tal proposito, Medeiros e colleghi (33) hanno descritto un modello gerarchico bayesiano al fine di combinare un approccio basato sull’evento con uno basato sul trend.
I risultati del loro studio hanno mostrato come l’integrazione dei due metodi sia superiore rispetto a ciascuno preso singolarmente.
Il confronto della performance dei diversi algoritmi, tuttavia, è reso difficoltoso dell’impossibilità di sapere con certezza se una serie perimetrica sia in progressione o meno.
Simulazioni computerizzate longitudinali di sequenze perimetriche con tassi di progressione predeterminati sono state utilizzate, ma sono limitate dalla loro estrema semplificazione in una malattia complessa quale è il glaucoma.
Conclusioni
La determinazione della progressione perimetrica resta tuttora un compito arduo per l’oftalmologo.
Diversi strumenti statistici, suddivisibili in “basati sull’evento” e “basati sul trend”, sono in grado di supportare il clinico nella valutazione delle sequenze perimetriche.
I metodi basati sul trend sono in grado di fornire una misura della velocità di progressione, e di discriminare pazienti a lenta e pazienti a rapida velocità di progressione.
Tuttavia nessuno dei metodi illustrati può essere ritenuto la metodica di riferimento.
La conoscenza delle proprietà, dei vantaggi e degli svantaggi di ciascuna metodica è utile per la corretta applicazione in ambito clinico e di ricerca.
1. Caprioli J. The importance of rates in glaucoma. Am J Ophthalmol 2008;145:191-2.
2. Advanced Glaucoma Intervention Study. 2. Visual field test scoring and reliability. Ophthalmology 1994;101:1445-55.
3. Heijl A, Leske MC, Bengtsson B, Bengtsson B, Hussein M, Early Manifest Glaucoma Trial G. Measuring visual field progression in the Early Manifest Glaucoma Trial. Acta Ophthalmol Scand 2003;81:286-93.
4. Schulzer M. Intraocular pressure reduction in normal-tension glaucoma patients. The Normal Tension Glaucoma Study Group. Ophthalmology 1992;99:1468-70.
5. Musch DC, Lichter PR, Guire KE, Standardi CL. The Collaborative Initial Glaucoma Treatment Study: study design, methods, and baseline characteristics of enrolled patients. Ophthalmology 1999;106:653-62.
6. Flammer J, Drance SM, Zulauf M. Differential light threshold. Short- and long-term fluctuation in patients with glaucoma, normal controls, and patients with suspected glaucoma. Arch Ophthalmol 1984;102:704-6.
7. Spry PG, Johnson CA. Identification of progressive glaucomatous visual field loss. Surv Ophthalmol 2002;47:158-73.
8. Wilensky JT, Joondeph BC. Variation in visual field measurements with an automated perimeter. Am J Ophthalmol 1984;97:328-31.
9. Aref AA, Budenz DL. Detecting Visual Field Progression. Ophthalmology 2017;124:S51-S6.
10. Cirineo N, Morales E, Lee JM, et al. Expert Evaluation of Visual Field Decay in Glaucoma Correlates With the Fast Component of Visual Field Loss. J Glaucoma 2017;26:902-10.
11. Heijl A, Bengtsson B, Chauhan BC, et al. A comparison of visual field progression criteria of 3 major glaucoma trials in early manifest glaucoma trial patients. Ophthalmology 2008;115:1557-65.
12. Vesti E, Johnson CA, Chauhan BC. Comparison of different methods for detecting glaucomatous visual field progression. Invest Ophthalmol Vis Sci 2003;44:3873-9.
13. Artes PH, Nicolela MT, LeBlanc RP, Chauhan BC. Visual field progression in glaucoma: total versus pattern deviation analyses. Invest Ophthalmol Vis Sci 2005;46:4600-6.
14. Artes PH, O’Leary N, Nicolela MT, Chauhan BC, Crabb DP. Visual field progression in glaucoma: what is the specificity of the Guided Progression Analysis? Ophthalmology 2014;121:2023-7.
15. Mayama C, Araie M, Suzuki Y, et al. Statistical evaluation of the diagnostic accuracy of methods used to determine the progression of visual field defects in glaucoma. Ophthalmology 2004;111:2117-25.
16. De Moraes CG, Liebmann JM, Levin LA. Detection and measurement of clinically meaningful visual field progression in clinical trials for glaucoma. Prog Retin Eye Res 2017;56:107-47.
17. Chauhan BC, Drance SM, Douglas GR. The use of visual field indices in detecting changes in the visual field in glaucoma. Invest Ophthalmol Vis Sci 1990;31:512-20.
18. Gardiner SK, Demirel S, De Moraes CG, et al. Series length used during trend analysis affects sensitivity to changes in progression rate in the ocular hypertension treatment study. Invest Ophthalmol Vis Sci 2013;54:1252-9.
19. Bengtsson B, Patella VM, Heijl A. Prediction of glaucomatous visual field loss by extrapolation of linear trends. Arch Ophthalmol 2009;127:1610-5.
20. Gardiner SK, Demirel S. Detecting Change Using Standard Global Perimetric Indices in Glaucoma. Am J Ophthalmol 2017;176:148-56.
21. Gardiner SK, Mansberger SL, Demirel S. Detection of Functional Change Using Cluster Trend Analysis in Glaucoma. Invest Ophthalmol Vis Sci 2017;58:BIO180-BIO90.
22. O’Leary N, Chauhan BC, Artes PH. Visual field progression in glaucoma: estimating the overall significance of deterioration with permutation analyses of pointwise linear regression (PoPLR). Invest Ophthalmol Vis Sci 2012;53:6776-84.
23. Heijl A, Lindgren G, Olsson J. Normal variability of static perimetric threshold values across the central visual field. Arch Ophthalmol 1987;105:1544-9.
24. Chen A, Nouri-Mahdavi K, Otarola FJ, Yu F, Afifi AA, Caprioli J. Models of glaucomatous visual field loss. Invest Ophthalmol Vis Sci 2014;55:7881-7.
25. Caprioli J, Mock D, Bitrian E, et al. A method to measure and predict rates of regional visual field decay in glaucoma. Invest Ophthalmol Vis Sci 2011;52:4765-73.
26. Pathak M, Demirel S, Gardiner SK. Nonlinear, multilevel mixed-effects approach for modeling longitudinal standard automated perimetry data in glaucoma. Invest Ophthalmol Vis Sci 2013;54:5505-13.
27. mohamed l, Morales E, Parivisutt N, et al. A Novel Index to Define the Rate of Visual Field Change in Glaucoma. Investigative Ophthalmology & Visual Science 2017;58:4741-.
28. Zhu H, Crabb DP, Ho T, Garway-Heath DF. More Accurate Modeling of Visual Field Progression in Glaucoma: ANSWERS. Invest Ophthalmol Vis Sci 2015;56:6077-83.
29. Medeiros FA, Zangwill LM, Bowd C, Mansouri K, Weinreb RN. The structure and function relationship in glaucoma: implications for detection of progression and measurement of rates of change. Invest Ophthalmol Vis Sci 2012;53:6939-46.
30. Yousefi S, Goldbaum MH, Varnousfaderani ES, et al. Detecting glaucomatous change in visual fields: Analysis with an optimization framework. Journal of Biomedical Informatics 2015;58:96-103.
31. Nouri-Mahdavi K, Hoffman D, Ralli M, Caprioli J. Comparison of methods to predict visual field progression in glaucoma. Arch Ophthalmol 2007;125:1176-81.
32. Anton A, Pazos M, Martin B, et al. Glaucoma progression detection: agreement, sensitivity, and specificity of expert visual field evaluation, event analysis, and trend analysis. Eur J Ophthalmol 2013;23:187-95.
33. Medeiros FA, Weinreb RN, Moore G, Liebmann JM, Girkin CA, Zangwill LM. Integrating event- and trend-based analyses to improve detection of glaucomatous visual field progression. Ophthalmology 2012;119:458-67.