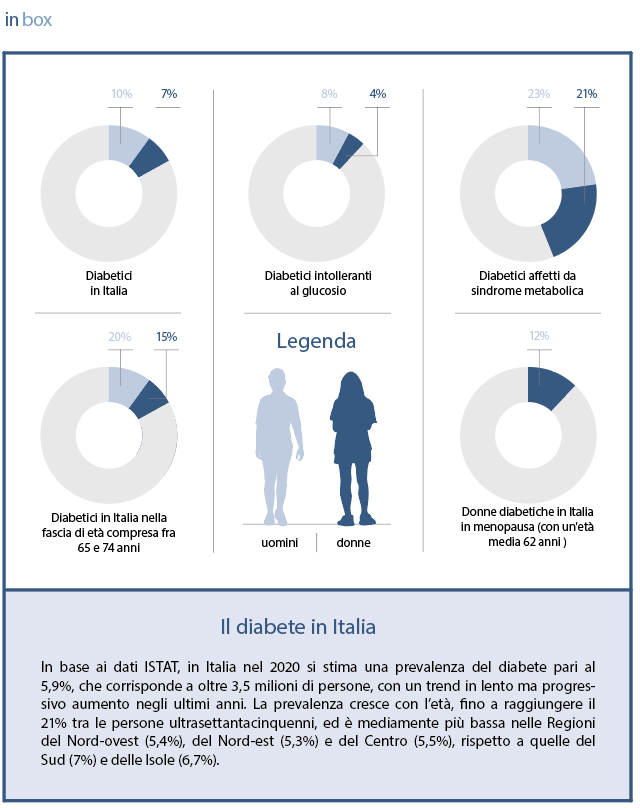
Riassunto
I progressi nell’imaging ultra-widefield (UWF) hanno permesso una più facile e più estesa visualizzazione della periferia retinica. Una percentuale significativa di lesioni da retinopatia diabetica (RD) sono localizzate in regioni retiniche più periferiche rispetto ai 7 campi standard proposti dallo studio Early treatment diabetic retinopathy study (ETDRS). Non considerare tali lesioni porta ad una sottostima della gravità del quadro clinico. La fluorangiografia UWF (UWF-FA) permette di identificare un maggior numero di lesioni periferiche e di definire con maggiore precisione lo stato di perfusione retinica al polo posteriore e nella periferia anche estrema. Gli occhi con lesioni prevalentemente periferiche (PPL) e quelli con aree più estese di non perfusione retinica sono quelli a maggior rischio di progressione di malattia e di viraggio verso la forma proliferante, una delle forme “vision-threatening” della RD. È fondamentale individuare prontamente tali casi per adottare una corretta strategia di monitoraggio e terapia. La gestione personalizzata del singolo paziente consente poi il conseguimento a lungo termine di migliori outcomes visivi e la stabilizzazione della malattia.
Una delle complicanze vascolari più comuni del diabete mellito è la retinopatia diabetica (RD), che è riportata essere la principale causa di compromissione visiva acquisita nella popolazione in età lavorativa (1). I livelli cronici di iperglicemia del diabete portano ad un progressivo danno retinico multifattoriale che si manifesta con la graduale comparsa di microaneurismi, microemorragie, essudati duri, noduli cotonosi, irregolarità di calibro dei vasi venosi e anomalie microvascolari intraretiniche (IRMA) (2). Queste manifestazioni definiscono la retinopatia diabetica non proliferante (RDNP) (2). Il danno vascolare cumulativo può risultare in aree retiniche non perfuse, l’ischemia retinica, e nella conseguente formazione delle anomale neovascolarizzazioni tipiche della RD proliferante (RDP) (2). Sia la RDNP che la RDP possono associarsi a edema maculare diabetico (EMD) (3). Quest’ultimo e la forma proliferante sono le complicanze “vision-threatening” della RD, ovvero quelle che mettono maggiormente a rischio la vista dei pazienti (3).
Stadiazione
Per la stadiazione della gravità della RD si utilizza la Diabetic retinopathy severity scale (DRSS), che valuta la severità clinica della malattia e il rischio di compromissione visiva. La DRSS si è dimostrata attendibile e riproducibile ed è stata utilizzata nei maggiori trials clinici sulla RD, come ad esempio l’Early treatment diabetic retinopathy study (ETDRS) (4) e quelli successivi dei farmaci oggi utilizzati per le terapie iniettive intravitreali. Questa stadiazione, tuttavia, mostra alcune limitazioni rilevanti. Innanzitutto si basa sulla valutazione del fondo oculare tramite fotografie a colori, e non comprende pertanto eventuali lesioni individuabili tramite la fluorangiografia (FA), come il leakage vascolare da abnorme permeabilità e la non-perfusione retinica. Inoltre, la DRSS tiene in considerazione una limitata regione retinica, considerata rappresentativa dell’intero quadro clinico, ovvero i 7 campi standard ETDRS (7SF) centrali, di 30 gradi ciascuno, accessibili con fundus/camere standard. La combinazione di queste 7 aree consente di ottenere circa 90 gradi di visualizzazione, con una copertura attorno al 30-35% dell’intera superficie retinica (4,5). L’avvento di metodiche di imaging ultra-widefield (UWF) consente oggi una esplorazione ben più ampia della periferia retinica con una copertura di circa l’82% della superficie totale e mediante un singolo scatto. Inoltre, attraverso la tecnologia UWF, è possibile anche visualizzare lo stato della perfusione retinica, sia al polo posteriore che nella periferia, tramite la fluorangiografia ultra-widefield (UWF-FA). Questo ha consentito, già un decennio fa, di affermare che la UWF-FA migliora il rilievo e la classificazione della RD rispetto alla FA standard delle aree ETDRS (6).
 Lesioni periferiche
Lesioni periferiche
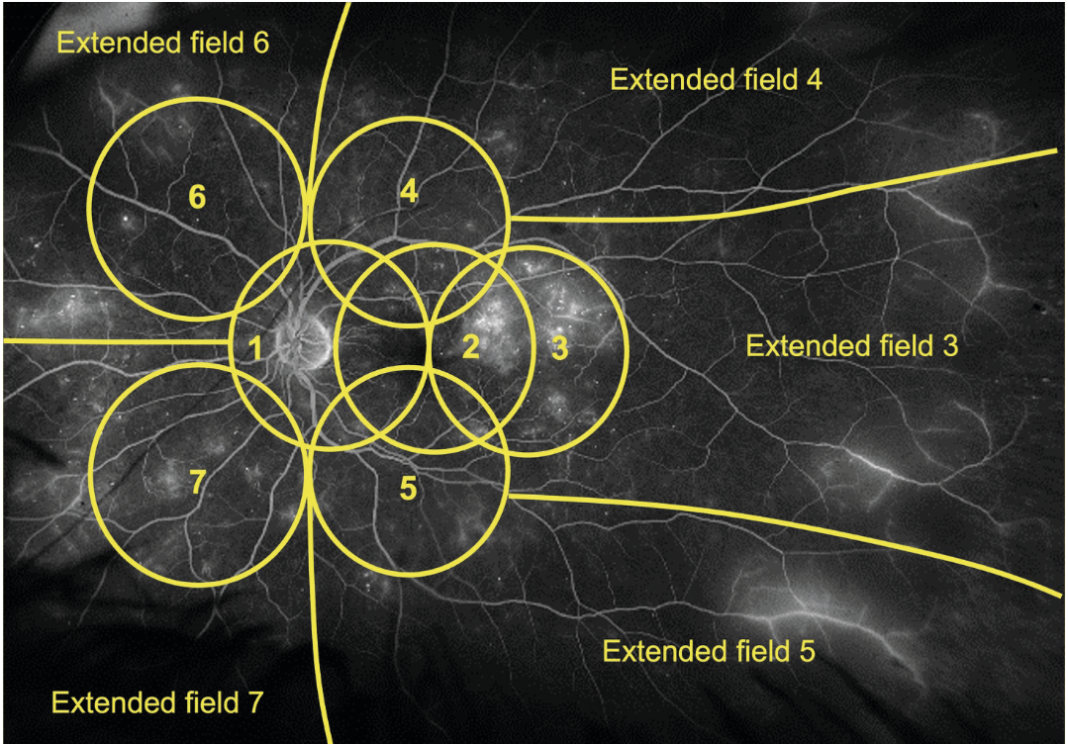
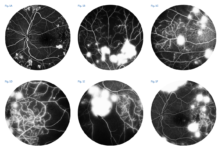
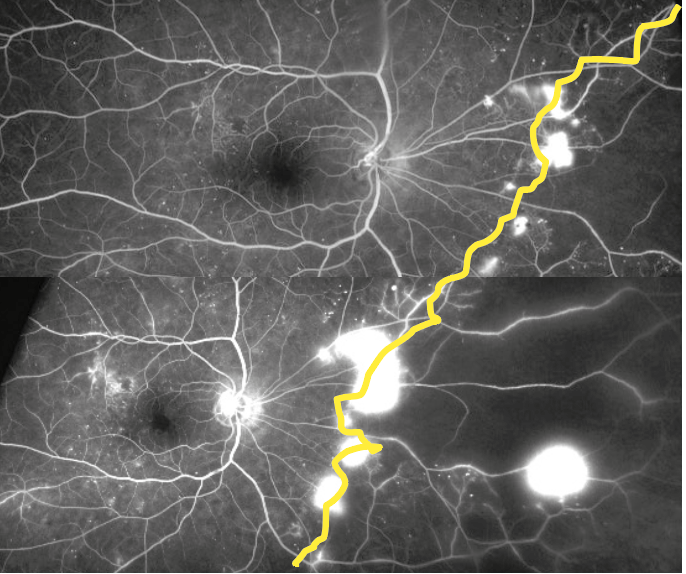
Vari studi si sono poi posti l’obiettivo di meglio caratterizzare le lesioni periferiche della RD e di correlarle alla prognosi dei pazienti, indipendentemente dal quadro clinico presente al polo posteriore (7,8). In uno studio del 2013 (9) Silva e colleghi hanno osservato che, in media, più del 60% delle lesioni da RD sono localizzate al di fuori dei 7SF e che, se si tenessero in considerazione anche le lesioni periferiche, circa il 10% dei casi sarebbero classificati in uno stadio di maggiore gravità. Quindi, escludere la periferia retinica porta ad una sottostima della severità della malattia. Gli stessi autori hanno poi proposto di considerare la presenza di lesioni in 5 ulteriori campi periferici in aggiunta ai 7 standard ETDRS (10). Ciononostante, non sono ancora standardizzate delle fotografie di riferimento con cui poter stadiare la severità delle lesioni periferiche (5). In assenza di tale standard, è stato suggerito di quantificare le lesioni da RD nei 5 campi estesi periferici e, nel caso in uno di questi venga riscontrato un maggior numero di lesioni rispetto al campo ETDRS ad esso adiacente, allora l’occhio in esame si dice essere affetto da lesioni prevalentemente periferiche (PPL) (figura 1) (11). Queste lesioni sono un riscontro frequente negli occhi con RD; uno studio di Verma et al (12) ha analizzato circa 1400 occhi riscontrando PPL intorno al 37% dei casi. Inoltre, è stato osservato che la presenza di PPL è associata ad una maggiore estensione di aree di non perfusione retinica alla UWF-FA (10). Questo pone le basi fisiopatologiche per spiegare il fatto che occhi con PPL sono stati descritti con un rischio 4 volte maggiore di progressione verso la RDP rispetto agli occhi privi di PPL (13). Questo è un dato di fondamentale importanza visto che il sistema ETDRS non prevede la valutazione delle lesioni periferiche. Di conseguenza, il DRCR Retina Network ha disegnato il Protocol AA, uno studio longitudinale osservazionale di occhi con RDNP senza edema maculare; questo trial mira a valutare in primo luogo se l’individuazione di lesioni periferiche (microaneurismi, microemorragie, IRMA, venous beading, e neovasi “elsewhere”) all’UWF-color o alla UWF-FA aumenti (rispetto alla sola valutazione dei 7SF) la nostra capacità di stadiare correttamente la severità della RD e di predire il peggioramento della patologia nel tempo (14). In aggiunta, il Protocol AA ha anche valutato se l’estensione delle aree di ischemia periferica correlasse con il rischio di peggioramento della malattia indipendentemente da altri fattori di rischio (14). I risultati a 4 anni di questo studio sono stati resi noti nel corso del 2022. In particolare, in un primo lavoro (8) è stato riportato che il rischio di peggioramento dello stadio alla DRSS o di incorrere in trattamenti è significativamente ed indipendentemente associato alla presenza al baseline di PPL alla UWF-FA. Questo diversamente dalle PPL identificate tramite foto a colori UWF, che non sono risultate essere correlate alla progressione di malattia (8). È interessante notare che è stata osservata una discrepanza del 36% tra la severità assegnata tramite grading delle foto a colori rispetto a quella della fluoroangiografia, determinando una non-intercambiabilità tra le due metodiche. La UWF-FA è capace, dunque, di rilevare un numero maggiore di lesioni rispetto al colore UWF (figura 2) (8). Questo dato supporta il ruolo clinico della FA nella corretta gestione del paziente diabetico: al baseline la fluorangiografia andrebbe sempre eseguita e poter disporre di metodiche UWF aumenta la possibilità di stadiare correttamente il livello di RD presente e scegliere la modalità più corretta di monitoraggio e gestione.

Aree di non perfusione
Come riportato sopra, una maggiore estensione di aree di non perfusione retinica alla FA è associata ad un maggior numero di PPL. In relazione a questo, è stato visto anche che circa il 70% delle aree di non-perfusione negli occhi con RDNP sono localizzate al di fuori del polo posteriore (13). Dunque, la presenza di un maggior numero di lesioni periferiche riflette il fatto che questa porzione di retina è quella che va incontro maggiormente a sofferenza vascolare. Il Protocol AA (7) ha anche rilevato che un maggiore indice al baseline di non-perfusione retinica (area di non-perfusione/area totale) si associa, a distanza di 4 anni, a un rischio maggiore di: progressione della RD, sviluppo di complicanze come neovasi ed emovitreo e necessità di trattamento. Il fattore che principalmente traina tale associazione è risultata essere la non-perfusione a livello del polo posteriore e della media periferia (7). Quindi, in definitiva, è molto interessante notare come il Protocol AA confermi ai giorni nostri che la non perfusione retinica è il fattore chiave che porta alla progressione neovascolare di malattia. Da un lato questo è stato dimostrato in maniera diretta, con la non perfusione centrale e medio-periferica direttamente associata alla progressione del quadro clinico (7). Dall’altro in maniera indiretta, con le PPL (a loro volta correlate con una maggiore estensione ischemica) associate in maniera indipendente con gli outcomes funzionali e strutturali (8). Questi risultati evidenziano come la FA sia in grado di rivelare un quadro retinico più grave rispetto a quanto obiettivabile con la sola esplorazione del fondo o con fotografie a colori. Di conseguenza, sebbene la DRSS costituisca ancora il gold standard, l’inclusione al baseline della UWF-FA nella gestione del paziente con RD permetterebbe un’identificazione più accurata degli occhi con RDNP severa, che hanno un maggior rischio di peggioramento verso complicanze vision-threatening e che pertanto necessiterebbero di strategie di trattamento più precoci o aggressive.
 Trattamento
Trattamento
Infatti, il trattamento della RDP e dell’EMD è stato nell’ultimo decennio oggetto di maggiori studi che hanno prodotto raccomandazioni terapeutiche, anche se con algoritmi differenti e basati su svariati parametri, locali e sistemici. In particolare, secondo il DR Committee dell’American Academy Ophthalmology, le “Management Recommendations (DR Preferred Practice Pattern, 2021)” indicano come “recommended” la fotocoagulazione laser pan-retinica (“scatter”) solo in caso di RDP ad alto rischio. Diversamente la gestione degli occhi con RDNP senza coinvolgimento maculare (in assenza di EMD) è più controversa. Le forme lievi sono convenzionalmente gestite tramite osservazione associata al buon controllo della condizione sistemica multifattoriale (4). Per quanto riguarda invece le forme di RDNP moderate e severe senza EMD abbiamo tre principali possibilità: osservazione, fotocoagulazione laser proattiva e, più di recente, iniezioni intravitreali di farmaci anti-angiogenici (anti-VEGF).
Il paradigma di trattamento di tali pazienti è complesso e non standardizzato e molti sono i fattori che devono essere tenuti in considerazione. Sebbene l’osservazione e il trattamento differito fino alla comparsa di complicanze vision-threatening sia un’opzione percorribile, alcuni studi, incentrati sia sul trattamento laser che sulle terapie iniettive, hanno suggerito l’efficacia di entrambi nel prevenire la progressione della patologia e l’insorgenza di complicanze. Per le terapie iniettive (sia anti-VEGF che steroidee) è stata dimostrata anche la capacità di miglioramento della severità di retinopatia nella DRSS. Tuttavia, nessuna delle due strategie terapeutiche è stata in grado di portare ad un miglioramento a lungo termine dell’acuità visiva nei pazienti trattati rispetto ai controlli; ma entriamo nel dettaglio. Il principale studio che ha valutato l’utilità del trattamento laser nei pazienti con RDNP nel prevenire lo sviluppo di RDP è stato, più di 30 anni fa, l’ETDRS (15). Tale studio ha dimostrato che la fotocoagulazione panretinica (PRP) precoce negli occhi con RDNP è in grado di ridurre fino al 50% il rischio di formazione dei neovasi rispetto al gruppo di controllo non laser-trattato (15). Eppure, il tasso di compromissione visiva a 5 anni era paragonabile tra i due gruppi e, in più, il trattamento laser presentava effetti collaterali (tra i più importanti: possibile esacerbazione dell’edema maculare e restringimento del campo visivo) (14,15). Per quanto riguarda invece la somministrazione intravitreale di farmaci anti-VEGF nei pazienti con RDNP senza EMD, i principali studi effettuati a proposito sono stati il PANORAMA (17) e il DRCR Retina Network Protocol W (18), entrambi trials clinici randomizzati di fase 3. Nello studio PANORAMA (17), 402 pazienti con RDNP moderata o moderata-severa sono stati assegnati casualmente a 1) placebo, 2) aflibercept 2 mg somministrato ogni 8 settimane dopo 5 dosi di carico mensili o 3) aflibercept 2 mg somministrato ogni 16 settimane dopo 3 dosi di carico mensili. Il Protocol W ha invece valutato il ruolo dell'aflibercept intravitreale (iniettato al baseline, ai mesi 1, 2 e 4; e poi ogni quattro mesi fino a due anni) rispetto a un placebo nel ridurre le complicanze a rischio per la vista negli occhi con RDNP moderato-severa (18). I pazienti sono stati poi seguiti per ulteriori due anni, e i risultati a 4 anni sono stati già presentati. Entrambi gli studi hanno raggiunto conclusioni simili al termine dei 2 anni, dimostrando un minore incidenza di complicanze vision-threatening (EMD coinvolgente il centro e RDP) e una maggiore probabilità di miglioramento del quadro clinico (riduzione dello stadio DRSS) negli occhi sottoposti a trattamento iniettivo rispetto allo sham (17,18). Visto che gli occhi con RDNP moderata e severa hanno rispettivamente 2.6 e 3.6 volte maggior rischio di compromissione visiva rispetto ad occhi con forme lievi di RDNP, riuscire ad arrestare la progressione o, ancor meglio, far regredire il grado di severità della retinopatia permetterebbe di ridurre la probabilità di andare incontro a cecità (19). Tuttavia, anche in questo caso, l’acuità visiva tra i due gruppi non differiva significativamente a 2 anni di distanza dall’inizio dei trials (17,18). I dati a 4 anni del Protocol W confermerebbero l’assenza di una vantaggio visivo nel tempo; questo induce considerazioni sull’utilità e tollerabilità di sottoporre i pazienti a un regime continuo di iniezioni intravitreali per rallentare la progressione di malattia e il rischio di complicanze, senza tuttavia un effettivo beneficio visivo. In più, i farmaci anti-VEGF comportano rischio di complicanze legate all’iniezione intravitreale. Anche se nei due trials l’incidenza, ad esempio, di endoftalmite è stata bassa (<1% nel Protocol W e 0% nel PANORAMA) resta comunque un rischio effettivo che si cumula con il numero delle iniezioni (17,18). Un altro fattore significativo è il carico di visite e procedure a cui il paziente è sottoposto. Nei due studi, il numero medio di giorni in cui i pazienti si sono dovuti recare in ospedale in 2 anni è stato di 15, mentre i pazienti con RDNP moderata e severa convenzionalmente vengono valutati 2-4 volte/anno (17,18). Resta importante anche considerare il burden che le iniezioni hanno sul sistema sanitario da un punto di vista di costi, spazi e personale dedicato. Inoltre, non sono noti gli outcomes real-world così come quelli a lungo termine, aspetto importante dal momento che spesso i pazienti diabetici sono giovani e in età lavorativa. Non sappiamo quanto a lungo tali pazienti dovrebbero essere iniettati, così come non abbiamo dati sull’incidenza di complicanze a 10 anni e oltre. Di fronte a un contesto così intricato, emerge la necessità di adattare e personalizzare il nostro approccio in base al quadro clinico completo del singolo paziente, tenendo in considerazione anche le sue esigenze personali e professionali. La qualità di vita del paziente rimane un elemento importante nella scelta terapeutica. Da un lato studi epidemiologici longitudinali hanno mostrato che la qualità di vita dei pazienti diminuisce con l’aggravarsi della malattia, dalla RDNP lieve fino alla RDP (3,20). Dall’altro, sottoporsi cronicamente a trattamenti frequenti per prevenire le complicanze maggiori senza però un beneficio visivo a lungo termine può rivelarsi gravoso e poco sostenibile per pazienti e strutture. Pertanto, Arabi e co-autori (3) si chiedono se i risultati del Protocol W e dello studio PANORAMA consentano di introdurre uno shift nel nostro paradigma gestionale della RDNP senza EMD. Forse no, concludono, perché la durata di aderenza del paziente alla terapia con anti-VEGF non è definita; bisogna inoltre tener presente che quello che appare un miglioramento del livello di RD al DRSS dopo le terapie iniettive con anti-VEGF è tale ma non comporta cambiamenti della perfusione retinica, non consente ri-perfusione (3). Questo come dimostrato grazie a studi wide-field con OCT-Angiography vs FA (21,22).
Laser
Il trattamento laser precoce dell'ischemia nella RD resta comunque un’alternativa terapeutica valida, in grado di portare a guadagni anatomici significativi che possono essere mantenuti a lungo termine garantire un’ottima prognosi funzionale, così come dimostrato nei pazienti con RDP. Infatti, la PRP ha rappresentato per molti anni il cardine del trattamento nelle forme proliferanti, riuscendo a dimezzare il rischio di perdita della visione centrale, così come mostrato dallo studio DRS (23). Successivamente, il Protocol S del DRCR Retina Network ha proposto il trattamento anti-VEGF come valida alternativa alla PRP per la RD proliferante, ma l’alto costo e gli scarsi outcomes in caso di perdita dei pazienti al follow-up hanno fatto sì che la PRP sia comunque rimasta un pilastro nella gestione dei pazienti con RDP (24). Nonostante la capacità della PRP di preservare la visione centrale, rimane l’effetto avverso rappresentato dal restringimento del campo visivo periferico. Riguardo quest’ultimo però, uno studio ancillare del Protocol S ha sì confermato la diminuzione della sensibilità del campo visivo nei pazienti sottoposti a laser per RDP, ma ha anche sorprendentemente rilevato una significativa perdita di sensibilità perimetrica nei pazienti trattati con farmaci anti-VEGF (25). Questi risultati hanno dunque sollevato l’ipotesi che ci siano altri fattori che contribuiscono alla compromissione del campo visivo nei pazienti con RD, come ad esempio la neurodegenerazione e il danno cumulativo indotto dalla deplezione di VEGF (25). In aggiunta, è stato negli ultimi anni proposto l’utilizzo della UWF-FA per guidare il trattamento laser indirizzato solo sulle zone ischemiche, effettuando una fotocoagulazione mirata senza compromettere il campo visivo di aree perfuse (figura 3) (26-28). Questo approccio “targeted” si è rilevato non inferiore nell’indurre la regressione della RDP rispetto alla PRP tradizionale (26,27). Questa modalità di trattamento laser costituisce un’opzione proattiva nel nostro ventaglio terapeutico anche per forme di RDNP severa (figura 2), capace di limitare le conseguenze indotte dall’ischemia con un impatto minore sulla qualità di vita del paziente.
Conclusioni
In conclusione, la capacità di diagnosticare precocemente e meglio la RD e la possibilità di riuscire a rallentare il peggioramento della malattia prevenendo l’insorgenza di gravi complicanze, ha fatto sì che la RDNP abbia attirato negli ultimi anni un’attenzione sempre maggiore. Saper quantificare correttamente la gravità del quadro clinico è essenziale per le nostre decisioni terapeutiche e la miglior gestione possibile del singolo paziente. In quest’ottica, usufruire di tutte le metodiche diagnostiche e delle alternative terapeutiche a nostra disposizione permette di ottenere migliori risultati anatomici e funzionali e garantire al paziente una ottima qualità di vita.
Gli autori dichiarano l'assenza di conflitti di interesse.
1. Shaw JE, Sicree RA, Zimmet PZ. Global estimates of the prevalence of diabetes for 2010 and 2030. Diabetes Res Clin Pract 2010;87:4–14.
2. Cheung N, Mitchell P, Wong TY. Diabetic retinopathy. The Lancet 2010;376:124–136.
3. Arabi A, Tadayoni R, Ahmadieh H, et al. Update on Management of Non-proliferative Diabetic Retinopathy without Diabetic Macular Edema; Is There a Paradigm Shift? J Ophthalmic Vis Res 2022;17:108–117.
4. Early Treatment Diabetic Retinopathy Study Research Group. Grading diabetic retinopathy from stereoscopic color fundus photographs–an extension of the modified Airlie House classification. ETDRS report number 10. Early Treatment Diabetic Retinopathy Study Research Group. Ophthalmology 1991;98:786–806.
5. Sadda SR. Peripheral lesions take DR imaging beyond ETDRS. Available at: http://www.retina-specialist.com/article/peripheral-lesions-take-dr-imaging-beyond-etdrs [Accessed January 22, 2023].
6. Wessel MM, Aaker GD, Parlitsis G, et al. Ultra-wide-field angiography improves the detection and classification of diabetic retinopathy. Retina Phila Pa 2012;32:785–791.
7. Silva PS, Marcus DM, Liu D, et al. Association of Ultra-Widefield Fluorescein Angiography-Identified Retinal Nonperfusion and the Risk of Diabetic Retinopathy Worsening Over Time. JAMA Ophthalmol 2022;140:936–945.
8. Marcus DM, Silva PS, Liu D, et al. Association of Predominantly Peripheral Lesions on Ultra-Widefield Imaging and the Risk of Diabetic Retinopathy Worsening Over Time. JAMA Ophthalmol 2022;140:946–954.
9. Silva PS, Cavallerano JD, Sun JK, et al. Peripheral lesions identified by mydriatic ultrawide field imaging: distribution and potential impact on diabetic retinopathy severity. Ophthalmology 2013;120:2587–2595.
10. Silva PS, Dela Cruz AJ, Ledesma MG, et al. Diabetic Retinopathy Severity and Peripheral Lesions Are Associated with Nonperfusion on Ultrawide Field Angiography. Ophthalmology 2015;122:2465–2472.
11. Silva PS, Cavallerano JD, Haddad NMN, et al. Peripheral Lesions Identified on Ultrawide Field Imaging Predict Increased Risk of Diabetic Retinopathy Progression over 4 Years. Ophthalmology 2015;122:949–956.
12. Verma A, Alagorie AR, Ramasamy K, et al. Distribution of peripheral lesions identified by mydriatic ultra-wide field fundus imaging in diabetic retinopathy. Graefes Arch Clin Exp Ophthalmol 2020;258:725–733.
13. Silva PS, Liu D, Glassman AR, et al. ASSESSMENT OF FLUORESCEIN ANGIOGRAPHY NONPERFUSION IN EYES WITH DIABETIC RETINOPATHY USING ULTRAWIDE FIELD RETINAL IMAGING. Retina Phila Pa 2022;42:1302–1310.
14. Aiello LP, Odia I, Glassman AR, et al. Comparison of Early Treatment Diabetic Retinopathy Study Standard 7-Field Imaging With Ultrawide-Field Imaging for Determining Severity of Diabetic Retinopathy. JAMA Ophthalmol 2019;137:65–73.
15. [No authors listed] Early photocoagulation for diabetic retinopathy. ETDRS report number 9. Early Treatment Diabetic Retinopathy Study Research Group. Ophthalmology 1991;98:766–785.
16. Royle P, Mistry H, Auguste P, et al. Pan-retinal photocoagulation and other forms of laser treatment and drug therapies for non-proliferative diabetic retinopathy: systematic review and economic evaluation. Health Technol Assess Winch Engl 2015;19:v–xxviii, 1–247.
17. Brown DM, Wykoff CC, Boyer D, et al. Evaluation of Intravitreal Aflibercept for the Treatment of Severe Nonproliferative Diabetic Retinopathy: Results From the PANORAMA Randomized Clinical Trial. JAMA Ophthalmol 2021;139:946–955.
18. Maturi RK, Glassman AR, Josic K, et al. Effect of Intravitreous Anti-Vascular Endothelial Growth Factor vs Sham Treatment for Prevention of Vision-Threatening Complications of Diabetic Retinopathy: The Protocol W Randomized Clinical Trial. JAMA Ophthalmol 2021;139:701–712.
19. Wykoff CC, Khurana RN, Nguyen QD, et al. Risk of Blindness Among Patients With Diabetes and Newly Diagnosed Diabetic Retinopathy. Diabetes Care 2021;44:748–756.
20. Yadav P, Singh SV, Nada M, Dahiya M. Impact of severity of diabetic retinopathy on quality of life in type 2 Indian diabetic patients. Int J Community Med Public Health 2021;8:207–211.
21. Bonnin S, Dupas B, Lavia C, et al. Anti-Vascular Endothelial Growth Factor Therapy Can Improve Diabetic Retinopathy Score Without Change in Retinal Perfusion. Retina Phila Pa 2019;39:426–434.
22. Couturier A, Rey P-A, Erginay A, et al. Widefield OCT-Angiography and Fluorescein Angiography Assessments of Nonperfusion in Diabetic Retinopathy and Edema Treated with Anti-Vascular Endothelial Growth Factor. Ophthalmology 2019;126:1685–1694.
23. Anon. Photocoagulation treatment of proliferative diabetic retinopathy. Clinical application of Diabetic Retinopathy Study (DRS) findings, DRS Report Number 8. The Diabetic Retinopathy Study Research Group. Ophthalmology 1981;88:583–600.
24. Gross JG, Glassman AR, Liu D, et al. Five-Year Outcomes of Panretinal Photocoagulation vs Intravitreous Ranibizumab for Proliferative Diabetic Retinopathy: A Randomized Clinical Trial. JAMA Ophthalmol 2018;136:1138–1148.
25. Maguire MG, Liu D, Glassman AR, et al. Visual Field Changes Over 5 Years in Patients Treated With Panretinal Photocoagulation or Ranibizumab for Proliferative Diabetic Retinopathy. JAMA Ophthalmol 2020;138:285–293.
26. Muqit MMK, Marcellino GR, Henson DB, et al. Optos-guided pattern scan laser (Pascal)-targeted retinal photocoagulation in proliferative diabetic retinopathy. Acta Ophthalmol (Copenh) 2013;91:251–258.
27. Nikkhah H, Ghazi H, Razzaghi MR, et al. Extended targeted retinal photocoagulation versus conventional pan-retinal photocoagulation for proliferative diabetic retinopathy in a randomized clinical trial. Int Ophthalmol 2018;38:313–321.
28. Cai S, Liu TYA. The Role of Ultra-Widefield Fundus Imaging and Fluorescein Angiography in Diagnosis and Treatment of Diabetic Retinopathy. Curr Diab Rep 2021;21:30.