Le neovascolarizzazioni maculari (MNV) non essudative costituiscono una entità clinica di frequente riscontro nei pazienti con degenerazione maculare legata all’età. Sono definite come MNV di tipo I non associate a segni di essudazione. Benché già descritte in passato attraverso studi istopatologici, queste lesioni hanno acquisito maggior interesse con l’avvento dell’angiografia al verde d’indocianina ma soprattutto con l’introduzione di metodiche non invasive come la tomografia a radiazione ottica (OCT) e l’OCT angiografia (OCTA). Tuttavia, ancora manca una loro precisa definizione e classificazione. Infatti, le MNV essudative comprendono tipi diversi di lesioni per aspetto e comportamento clinico. In questo articolo abbiamo riassunto le caratteristiche principali delle MNV non essudative allo scopo di fornire una linea di orientamento per il loro inquadramento e la loro gestione clinica.
La degenerazione maculare legata all'età (age related macular degeneration - AMD) è la causa più comune di cecità nei paesi sviluppati, con una prevalenza in continuo aumento e che si stima raggiungerà i 288 milioni di individui colpiti in tutto il mondo nel 2040 (1).
I segni clinici che caratterizzano l’AMD sono rappresentati da drusen e da anomalie dell'epitelio pigmentato retinico (retinal pigment epithelium - RPE) (2). Tali alterazioni definiscono le forme iniziali e intermedie della malattia (2). Queste forme possono eventualmente evolvere in uno stadio neovascolare, in cui si registra la formazione di neovascolarizzazioni (NV) coroideali o retiniche.
I tassi di progressione verso l’AMD neovascolare variano dal 3,2% al 15,2%, configurando l’AMD come uno dei disturbi più frequentemente complicati da neovascolarizzazioni (3). Queste ultime compaiono, infatti, anche in malattie retiniche diverse dall’AMD, tra cui la degenerazione maculare miopica, le malattie facenti parte dello spettro della pachicoroide, le strie angioidi, le distrofie corioretiniche ereditarie (4-8).
Neovascolarizzazioni maculari
Per lungo tempo le NV presenti in occhi con AMD sono state definite coroideali (choroidal neovascularization - CNV), poiché si credeva che tali lesioni potessero originare unicamente dallo strato coriocapillare della coroide (NV di tipo 1 e 2). Successivamente, è stato descritto un terzo tipo di NV originanti dalla circolazione intraretinica (9). Di conseguenza, è stato proposto di raggruppare tali lesioni sotto il più generico termine di neovascolarizzazioni maculari (macular neovascularization - MNV) (10). Le MNV sono tipicamente associate a essudazione con conseguente calo visivo. Alla tomografia a coerenza ottica (optical coherence tomography - OCT), l’essudazione di una MNV si presenta come liquido iporeflettente sottoretinico e/o intraretinico o materiale iperriflettente sottoretinico (subretinal hyperreflective material - SHRM) (11). Tuttavia, si è osservato che le NV possono rimanere in uno stato non essudativo per periodi di tempo variabili (11). Queste lesioni inattive sono riscontrate in pazienti spesso asintomatici e la loro esistenza solleva nuove implicazioni patogenetiche e considerazioni per la gestione clinica (11). La presenza di neovascolarizzazioni di tipo 1 in pazienti con forma secca di AMD era già stata segnalata in studi istopatologici degli anni ’70 (12). Questi ritrovati sono stati poi confermati in vivo alla fine del secolo scorso con l’introduzione dell’angiografia con verde di indocianina (ICGA) (13). Questa tecnica ha permesso di rivelare in occhi con soft drusen la presenza di membrane neovascolari al di sotto dell’RPE in assenza di segni di essudazione (13). Infine, l’avvento di metodiche di imaging multimodali più sofisticate e non invasive, tra cui l’OCT e l’OCT angiografia (OCTA), ha permesso una migliore caratterizzazione di tali entità (11). Nel 2012, Amissah-Arthur et al (14) hanno studiato longitudinalmente una coorte di pazienti con AMD. Gli autori si sono poi concentrati sugli occhi andati poi incontro a essudazione e in particolare hanno analizzato gli OCT precedenti l’essudazione. È interessante notare che sono stati trovati segni di neovascolarizzazione negli OCT precedenti l’essudazione nell’88% dei casi (14). Successivamente, Querques et al hanno descritto una serie di occhi con neovascolarizzazioni di tipo 1 mai trattate in precedenza e non associate a essudazione evidente all'OCT strutturale per almeno 6 mesi, definendo queste entità come MNV “quiescenti" (15). Da allora, diverse ricerche hanno esplorato l'incidenza, la prevalenza e la storia naturale di queste lesioni e ne hanno proposto diverse nomenclature, tra cui "quiescenti", "subcliniche" e la terminologia più recentemente raccomandata di "non essudative" (16).
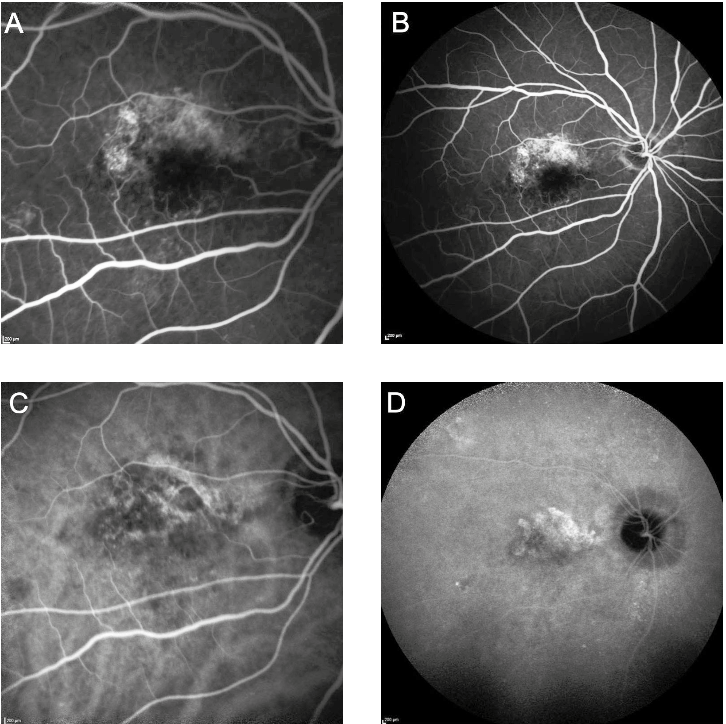
 MNV essudative e non essudative
MNV essudative e non essudative
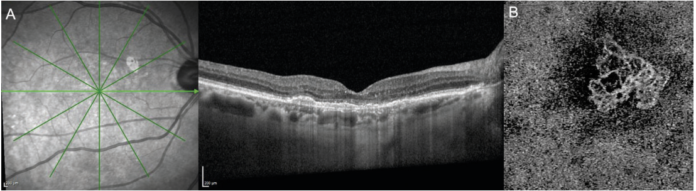
Il gruppo CONAN nel 2020 ha riconosciuto come entità distinta la MNV non essudativa, ma non ha ravvisato la necessità di adottare criteri temporali per la sua definizione e quindi neanche il termine “quiescente” (10). In una recente review (11), Sacconi e collaboratori hanno fornito una panoramica dettagliata delle MNV non essudative, evidenziando che le stesse debbano essere inquadrate come uno spettro ampio di lesioni differenti per fisiopatologia, morfologia e caratteristiche cliniche. Spesso, infatti, nella pratica clinica vediamo MNV non essudative che rimangono stabili per anni, opposte ad altre che sviluppano essudazione nell’arco di pochi mesi (11). Di conseguenza gli autori suggeriscono di distinguere tra MNV “quiescenti”, ovvero MNV non essudative che si mantengono tali per almeno 6 mesi, e MNV “subcliniche” ovvero MNV non associate a essudazione al momento della diagnosi che possono poi eventualmente evolvere in quiescenti in caso non si attivino entro 6 mesi (11). Il termine generico di MNV non essudativa comprende dunque entrambe le entità e indica una NV di tipo 1 non trattata e non associata a essudazione intra- o sottoretinica all’OCT strutturale (10). Di conseguenza, le MNV non essudative appaiono all’OCT come dei sollevamenti dell’EPR con conseguente dissociazione tra l’EPR stesso e la membrana di Bruch (15). Questo sdoppiamento tra EPR e BM all’OCT B-scan è definito come “double layer sign” (DLS) (17). Questo segno però indica solamente la separazione tra questi due strati e non implica necessariamente che sia presente una NV (11).
 La conferma della presenza di una eventuale NV non essudativa si ha infatti tramite OCTA o ICGA. Sforzi sono stati fatti nel tentativo di descrivere delle caratteristiche del DLS che, se presenti, ci permettono di affermare già dall’OCT strutturale che è presente una NV non essudativa. In particolare, un DLS di massimo 100 μm di altezza e minimo 1000 μm di larghezza orizzontale è probabile che nasconda una MNV non essudativa. Un DLS di questo tipo è definito come “shallow irregular RPE elevation” (SIRE) (18). Il cut-off di 1000 μm è arbitrario ed è comunque possibile riscontrare anche MNV più piccole di 1000 μm. Tuttavia, è stato dimostrato che adottando questi parametri dimensionali la presenza di SIRE è associata con buona probabilità a una MNV non essudativa, configurandolo come un valido strumento nello screening e diagnosi di MNV non essudative nell’ambito dell’AMD secca (18). Dopo aver diagnosticato una MNV non associata a segni di essudazione (subclinica), la sfida più significativa nell'affrontare tale tipo di lesioni è comprendere la distinzione tra un fenotipo stabile, che rimane inattivo nel tempo (realmente quiescente), rispetto a una nuova lesione vascolare che appare come inattiva poiché nella sua fase iniziale di crescita (11). Queste ultime, infatti, sono a elevato rischio di essudazione a breve termine e pertanto rappresentano una MNV in una fase pre-essudativa del suo fisiologico ciclo vitale (11). Il mantenimento di uno stato non essudativo per almeno 6 mesi aiuta a differenziare questi diversi tipi di lesioni. Spesso sono necessari controlli frequenti per escludere definitivamente lo sviluppo di essudato transitorio durante l'intervallo di 6 mesi (11). Non appena riscontrata, dunque, ogni MNV non associata a fluido intra- o sottoretinico deve essere seguita strettamente perché la letteratura dimostra che il nuovo riscontro di una MNV non essudativa rappresenta comunque un forte fattore di rischio per futura essudazione (11). Anche dopo i primi 6 mesi di follow-up una MNV quiescente necessita comunque di un attento monitoraggio per rilevare precocemente possibili segni di attività. L’esatto meccanismo di conversione da uno stato non-essudativo a uno essudativo non è noto fino in fondo. Alcuni ipotizzano che l’essudazione sia il risultato di una aumentata permeabilità vascolare durante il ciclo vitale di una MNV, altri che lo stravaso di liquido possa essere spiegato da altri fattori come una compromissione dell’EPR dovuta a uno stress cronico indotto dalla MNV oppure da una sottostante ischemia coroideale (19). Varie ricerche hanno inoltre cercato di stimare il tasso di conversione verso l’essudazione delle MNV non essudative. Tali studi sono prevalentemente incentrati su pazienti con AMD intermedia e sono altresì molto eterogenei tra di loro per quanto riguarda la selezione dei pazienti, il tipo di macchinario utilizzato per la diagnosi di MNV, e soprattutto l’esatta definizione di MNV non essudativa (11). Conseguentemente, la percentuale di pazienti con AMD intermedia e MNV non essudative che evolve verso l’essudazione è molto variabile tra i vari studi. Infatti, studi che includono MNV cosiddette subcliniche (ovvero non associate al momento dello studio a essudazione senza criteri temporali) in pazienti con AMD essudativa nell’occhio controlaterale riportano un tasso di incidenza di essudazione a 12 mesi che arriva fino al 52% (20). Di converso, la selezione di MNV quiescenti a prescindere dallo stato dell’occhio controlaterale porta il tasso di conversione a un anno al 6,6% (21). A 2 anni, invece, il rischio cumulativo di essudazione è stimato essere mediamente 13,6 volte maggiore nei pazienti con MNV non essudative rispetto a pazienti senza lesioni evidenti (22). Questo rimarca come sia comunque importante il frequente monitoraggio di questa popolazione di pazienti e come l’individuazione di biomarkers in grado di predire, al baseline o nel corso del follow-up, una futura essudazione della lesione costituisca uno strumento fondamentale per permettere un trattamento tempestivo al riscontro del più precoce segno di attività (11). Infatti, è ben stabilito che quanto prima si interviene con la terapia anti-vascular endothelial growth factor (VEGF) dopo la comparsa di essudazione, migliore sarà l’outcome visivo a causa della riduzione del rischio di sviluppo di fibrosi e atrofia (11). Diversi gruppi di autori hanno provato a identificare fattori predittivi di essudazione per le MNV non essudative, attraverso strategie diverse. La velocità di crescita dimensionale nel tempo della lesione neovascolare sembra essere il fattore più indicativo di futura essudazione (11). Infatti, anche se alcune lesioni appaiono “clinicamente quiescenti”, la maggior parte di esse mantiene un certo grado di attività biologica, mostrando un aumento di dimensioni all’OCTA lungo i vari follow-up (15,21). A un aumento dell’area della neovascolarizzazione non si accompagnano solitamente modificazioni della densità vascolare, differentemente dai fenotipi di MNV “attivi” in cui l’aumento di densità dei vasi porta poi frequentemente a essudazione (15,21). Inoltre, la crescita della MNV è spesso accompagnata da un suo rimodellamento, con aumento del numero di anastomosi e del numero di ramificazioni capillari. Pertanto, anche il riscontro OCTA di una conformazione ramificata potrebbe essere predittivo di essudazione, anche se tale dato non è stato ancora validato (23). Sulla falsa riga dei reperti OCTA, Invernizzi e colleghi hanno dimostrato che circa 8 mesi prima dell’inizio dell’essudazione è solitamente riscontrabile all’OCT strutturale un ispessimento degli strati retinici esterni (dalla membrana limitante esterna alla membrana di Bruch) (24). L’ispessimento accelera nei 2 mesi precedenti all’essudazione (24). Questo dato è la conferma all’OCT strutturale di quanto sopra riportato, ovvero che vi è una reale crescita della membrana neovascolare prima dell’essudazione e che tale crescita inizia alcuni mesi prima dell’effettiva essudazione. Si può dunque ipotizzare che l’attivazione di una MNV sia dovuta all’instaurarsi di processi angiogenetici che portano alla crescita della lesione ma causano congiuntamente stravaso di fluido (11). A questo proposito, uno studio di Querques et al ha analizzato le caratteristiche OCTA di tre diverse tipologie di MNV essudative: le MNV che sviluppano essudazione precocemente (< 6 mesi dalla diagnosi), quelle che essudano dopo i 6 mesi e infine le MNV quiescenti (25). È stato interessante notare che le lesioni che si attivano in breve tempo non solo sono caratterizzate da una velocità di crescita più elevata rispetto alle lesioni quiescenti ma anche da una maggiore densità vascolare al baseline (25). Quest’ultima riflette la presenza di un maggior numero di capillari a livello della MNV. In questo caso, il processo che sostiene maggiormente la crescita della lesione è ipotizzato essere quello angiogenetico (25). L’angiogenesi è un processo VEGF-dipendente in cui nuove cellule endoteliali si dipartono da capillari preesistenti per originarne di nuovi. I capillari neoformati sono però caratterizzati da elevata permeabilità e alto rischio di essudazione (25). Sulla base di questa fisiopatologia è chiaro il motivo per cui il trattamento con farmaci anti-VEGF sia efficace nel rallentare o arrestare il processo di angiogenesi (25).
La conferma della presenza di una eventuale NV non essudativa si ha infatti tramite OCTA o ICGA. Sforzi sono stati fatti nel tentativo di descrivere delle caratteristiche del DLS che, se presenti, ci permettono di affermare già dall’OCT strutturale che è presente una NV non essudativa. In particolare, un DLS di massimo 100 μm di altezza e minimo 1000 μm di larghezza orizzontale è probabile che nasconda una MNV non essudativa. Un DLS di questo tipo è definito come “shallow irregular RPE elevation” (SIRE) (18). Il cut-off di 1000 μm è arbitrario ed è comunque possibile riscontrare anche MNV più piccole di 1000 μm. Tuttavia, è stato dimostrato che adottando questi parametri dimensionali la presenza di SIRE è associata con buona probabilità a una MNV non essudativa, configurandolo come un valido strumento nello screening e diagnosi di MNV non essudative nell’ambito dell’AMD secca (18). Dopo aver diagnosticato una MNV non associata a segni di essudazione (subclinica), la sfida più significativa nell'affrontare tale tipo di lesioni è comprendere la distinzione tra un fenotipo stabile, che rimane inattivo nel tempo (realmente quiescente), rispetto a una nuova lesione vascolare che appare come inattiva poiché nella sua fase iniziale di crescita (11). Queste ultime, infatti, sono a elevato rischio di essudazione a breve termine e pertanto rappresentano una MNV in una fase pre-essudativa del suo fisiologico ciclo vitale (11). Il mantenimento di uno stato non essudativo per almeno 6 mesi aiuta a differenziare questi diversi tipi di lesioni. Spesso sono necessari controlli frequenti per escludere definitivamente lo sviluppo di essudato transitorio durante l'intervallo di 6 mesi (11). Non appena riscontrata, dunque, ogni MNV non associata a fluido intra- o sottoretinico deve essere seguita strettamente perché la letteratura dimostra che il nuovo riscontro di una MNV non essudativa rappresenta comunque un forte fattore di rischio per futura essudazione (11). Anche dopo i primi 6 mesi di follow-up una MNV quiescente necessita comunque di un attento monitoraggio per rilevare precocemente possibili segni di attività. L’esatto meccanismo di conversione da uno stato non-essudativo a uno essudativo non è noto fino in fondo. Alcuni ipotizzano che l’essudazione sia il risultato di una aumentata permeabilità vascolare durante il ciclo vitale di una MNV, altri che lo stravaso di liquido possa essere spiegato da altri fattori come una compromissione dell’EPR dovuta a uno stress cronico indotto dalla MNV oppure da una sottostante ischemia coroideale (19). Varie ricerche hanno inoltre cercato di stimare il tasso di conversione verso l’essudazione delle MNV non essudative. Tali studi sono prevalentemente incentrati su pazienti con AMD intermedia e sono altresì molto eterogenei tra di loro per quanto riguarda la selezione dei pazienti, il tipo di macchinario utilizzato per la diagnosi di MNV, e soprattutto l’esatta definizione di MNV non essudativa (11). Conseguentemente, la percentuale di pazienti con AMD intermedia e MNV non essudative che evolve verso l’essudazione è molto variabile tra i vari studi. Infatti, studi che includono MNV cosiddette subcliniche (ovvero non associate al momento dello studio a essudazione senza criteri temporali) in pazienti con AMD essudativa nell’occhio controlaterale riportano un tasso di incidenza di essudazione a 12 mesi che arriva fino al 52% (20). Di converso, la selezione di MNV quiescenti a prescindere dallo stato dell’occhio controlaterale porta il tasso di conversione a un anno al 6,6% (21). A 2 anni, invece, il rischio cumulativo di essudazione è stimato essere mediamente 13,6 volte maggiore nei pazienti con MNV non essudative rispetto a pazienti senza lesioni evidenti (22). Questo rimarca come sia comunque importante il frequente monitoraggio di questa popolazione di pazienti e come l’individuazione di biomarkers in grado di predire, al baseline o nel corso del follow-up, una futura essudazione della lesione costituisca uno strumento fondamentale per permettere un trattamento tempestivo al riscontro del più precoce segno di attività (11). Infatti, è ben stabilito che quanto prima si interviene con la terapia anti-vascular endothelial growth factor (VEGF) dopo la comparsa di essudazione, migliore sarà l’outcome visivo a causa della riduzione del rischio di sviluppo di fibrosi e atrofia (11). Diversi gruppi di autori hanno provato a identificare fattori predittivi di essudazione per le MNV non essudative, attraverso strategie diverse. La velocità di crescita dimensionale nel tempo della lesione neovascolare sembra essere il fattore più indicativo di futura essudazione (11). Infatti, anche se alcune lesioni appaiono “clinicamente quiescenti”, la maggior parte di esse mantiene un certo grado di attività biologica, mostrando un aumento di dimensioni all’OCTA lungo i vari follow-up (15,21). A un aumento dell’area della neovascolarizzazione non si accompagnano solitamente modificazioni della densità vascolare, differentemente dai fenotipi di MNV “attivi” in cui l’aumento di densità dei vasi porta poi frequentemente a essudazione (15,21). Inoltre, la crescita della MNV è spesso accompagnata da un suo rimodellamento, con aumento del numero di anastomosi e del numero di ramificazioni capillari. Pertanto, anche il riscontro OCTA di una conformazione ramificata potrebbe essere predittivo di essudazione, anche se tale dato non è stato ancora validato (23). Sulla falsa riga dei reperti OCTA, Invernizzi e colleghi hanno dimostrato che circa 8 mesi prima dell’inizio dell’essudazione è solitamente riscontrabile all’OCT strutturale un ispessimento degli strati retinici esterni (dalla membrana limitante esterna alla membrana di Bruch) (24). L’ispessimento accelera nei 2 mesi precedenti all’essudazione (24). Questo dato è la conferma all’OCT strutturale di quanto sopra riportato, ovvero che vi è una reale crescita della membrana neovascolare prima dell’essudazione e che tale crescita inizia alcuni mesi prima dell’effettiva essudazione. Si può dunque ipotizzare che l’attivazione di una MNV sia dovuta all’instaurarsi di processi angiogenetici che portano alla crescita della lesione ma causano congiuntamente stravaso di fluido (11). A questo proposito, uno studio di Querques et al ha analizzato le caratteristiche OCTA di tre diverse tipologie di MNV essudative: le MNV che sviluppano essudazione precocemente (< 6 mesi dalla diagnosi), quelle che essudano dopo i 6 mesi e infine le MNV quiescenti (25). È stato interessante notare che le lesioni che si attivano in breve tempo non solo sono caratterizzate da una velocità di crescita più elevata rispetto alle lesioni quiescenti ma anche da una maggiore densità vascolare al baseline (25). Quest’ultima riflette la presenza di un maggior numero di capillari a livello della MNV. In questo caso, il processo che sostiene maggiormente la crescita della lesione è ipotizzato essere quello angiogenetico (25). L’angiogenesi è un processo VEGF-dipendente in cui nuove cellule endoteliali si dipartono da capillari preesistenti per originarne di nuovi. I capillari neoformati sono però caratterizzati da elevata permeabilità e alto rischio di essudazione (25). Sulla base di questa fisiopatologia è chiaro il motivo per cui il trattamento con farmaci anti-VEGF sia efficace nel rallentare o arrestare il processo di angiogenesi (25).
Al contrario, le MNV quiescenti dimostrano una minore densità vascolare, a indicare la presenza di un possibile processo di arteriogenesi alla base del sostentamento della lesione stessa (25). L’arteriogenesi è un processo differente dall’angiogenesi, in quanto non si ha la continua formazione di nuovi capillari, ma la dilatazione dei vasi preesistenti dovuta al rimodellamento e alla proliferazione delle cellule muscolari lisce e della matrice extracellulare che fanno parte della parete dei neovasi (25). Questo processo è scatenato da un aumentato flusso sanguigno in alcuni vasi dovuto all’occlusione o all’insufficienza dei vasi circostanti (25). L’aumentato flusso causa un eccessivo stress sulle cellule endoteliali che di conseguenza innescano processi proliferativi (25). L’arteriogenesi non è VEGF-dipendente e pertanto le MNV quiescenti risultano meno responsive agli anti-VEGF rispetto alle MNV alimentate da processi angiogenetici (25). In definitiva, lo sviluppo di ogni MNV è inizialmente VEGF (i.e. angiogenesi) – dipendente (11). Successivamente, però, in alcuni casi si verifica l’occlusione di alcuni vasi (probabilmente per i bassi livelli di VEGF) che provoca un aumento pressorio nei vasi circostanti (11). Da ciò ne consegue una “maturazione” di tali vasi che arterializzandosi diminuiscono la loro permeabilità (11). In conclusione, le neovascolarizzazioni non essudative rappresentano uno scenario clinico rilevante nell’attuale gestione dei pazienti con AMD. Infatti, l’utilizzo di imaging multimodale ha evidenziato come queste entità siano un riscontro comune (11). Considerato che la loro presenza si associa a un rischio maggiore di evoluzione verso l’AMD essudativa, la loro corretta identificazione e caratterizzazione sono di cruciale importanza. Nell’attesa di un consensus relativo alla definizione dei differenti sottotipi di MNV essudative, una strategia di sorveglianza attiva con particolare attenzione verso i segni OCT e OCTA di futura essudazione appare essere la strada più indicata verso migliori outcomes visivi a lungo termine.
Gli autori dichiarano l'assenza di conflitti di interesse.
1. Wong WL, Su X, Li X, et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet Glob Health 2014;2:e106-116.
2. Ferris FL, Davis MD, Clemons TE, et al. A simplified severity scale for age-related macular degeneration: AREDS Report No. 18. Arch Ophthalmol Chic Ill 1960 2005;123:1570–1574.
3. Chakravarthy U, Bailey CC, Scanlon PH, et al. Progression from Early/Intermediate to Advanced Forms of Age-Related Macular Degeneration in a Large UK Cohort: Rates and Risk Factors. Ophthalmol Retina 2020;4:662–672.
4. Parodi MB, Arrigo A, Romano F, et al. Hyperreflective Foci Number Correlates with Choroidal Neovascularization Activity in Angioid Streaks. Invest Ophthalmol Vis Sci 2018;59:3314–3319.
5. Dansingani KK, Balaratnasingam C, Klufas MA, et al. Optical Coherence Tomography Angiography of Shallow Irregular Pigment Epithelial Detachments In Pachychoroid Spectrum Disease. Am J Ophthalmol 2015;160:1243-1254.e2.
6. Patel RC, Gao SS, Zhang M, et al. Optical Coherence Tomography Angiography of Choroidal Neovascularization in Four Inherited Retinal Dystrophies. Retina Phila Pa 2016;36:2339–2347.
7. Spaide RF. Choroidal neovascularization in younger patients. Curr Opin Ophthalmol 1999;10:177–181.
8. Ohno-Matsui K, Wu P-C, Yamashiro K, et al. IMI Pathologic Myopia. Invest Ophthalmol Vis Sci 2021;62:5.
9. Hartnett ME, Weiter JJ, Staurenghi G, Elsner AE. Deep retinal vascular anomalous complexes in advanced age-related macular degeneration. Ophthalmology 1996;103:2042–2053.
10. Spaide RF, Jaffe GJ, Sarraf D, et al. Consensus Nomenclature for Reporting Neovascular Age-Related Macular Degeneration Data: Consensus on Neovascular Age-Related Macular Degeneration Nomenclature Study Group. Ophthalmology 2020;127:616–636.
11. Sacconi R, Fragiotta S, Sarraf D, et al. Towards a better understanding of non-exudative choroidal and macular neovascularization. Prog Retin Eye Res 2023;92:101113.
12. Sarks SH. New vessel formation beneath the retinal pigment epithelium in senile eyes. Br J Ophthalmol 1973;57:951–965.
13. Hanutsaha P, Guyer DR, Yannuzzi LA, et al. Indocyanine-green videoangiography of drusen as a possible predictive indicator of exudative maculopathy. Ophthalmology 1998;105:1632–1636.
14. Amissah-Arthur KN, Panneerselvam S, Narendran N, Yang YC. Optical coherence tomography changes before the development of choroidal neovascularization in second eyes of patients with bilateral wet macular degeneration. Eye 2012;26:394–399.
15. Querques G, Srour M, Massamba N, et al. Functional Characterization and Multimodal Imaging of Treatment-Naïve “Quiescent” Choroidal Neovascularization. Invest Ophthalmol Vis Sci 2013;54:6886–6892.
16. Chen L, Messinger JD, Sloan KR, et al. Nonexudative Macular Neovascularization Supporting Outer Retina in Age-Related Macular Degeneration: A Clinicopathologic Correlation. Ophthalmology 2020;127:931–947.
17. Sato T, Kishi S, Watanabe G, et al. Tomographic features of branching vascular networks in polypoidal choroidal vasculopathy. Retina Phila Pa 2007;27:589–594.
18. Narita C, Wu Z, Rosenfeld PJ, et al. Structural OCT Signs Suggestive of Subclinical Nonexudative Macular Neovascularization in Eyes with Large Drusen. Ophthalmology 2020;127:637–647.
19. Hilely A, Au A, Freund KB, et al. Non-neovascular age-related macular degeneration with subretinal fluid. Br J Ophthalmol 2021;105:1415–1420.
20. Solecki L, Loganadane P, Gauthier A-S, et al. Predictive factors for exudation of quiescent choroidal neovessels detected by OCT angiography in the fellow eyes of eyes treated for a neovascular age-related macular degeneration. Eye 2021;35:644–650.
21. Carnevali A, Sacconi R, Querques L, et al. Natural History of Treatment-Naïve Quiescent Choroidal Neovascularization in Age-Related Macular Degeneration Using OCT Angiography. Ophthalmol Retina 2018;2:922–930.
22. Yang J, Zhang Q, Motulsky EH, et al. Two-Year Risk of Exudation in Eyes with Nonexudative Age-Related Macular Degeneration and Subclinical Neovascularization Detected with Swept Source Optical Coherence Tomography Angiography. Am J Ophthalmol 2019;208:1–11.
23. Al-Sheikh M, Iafe NA, Phasukkijwatana N, et al. Biomarkers of Neovascular Activity in Age-Related Macular Degeneration Using Optical Coherence Tomography Angiography. Retina Phila Pa 2018;38:220–230.
24. Invernizzi A, Parrulli S, Monteduro D, et al. Outer Retinal Layer Thickening Predicts the Onset of Exudative Neovascular Age-Related Macular Degeneration. Am J Ophthalmol 2021;231:19–27.
25. Querques G, Sacconi R, Capuano V, et al. Treatment-naïve quiescent macular neovascularization secondary to AMD: The 2019 Young Investigator Lecture of Macula Society. Eur J Ophthalmol 2021;31:3164–3176.